
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические преобразователи
|
|
|
|
Принцип действия и конструкция. Электролитические (кондуктометрические) преобразователи. Принцип действия электролитических преобразователей основан на зависимости электропроводности раствора электролита от его концентрации. Как известно, электропроводность дистиллированной воды очень мала. При растворении в ней кислот, солей, оснований (электролитов) электропроводность возрастает. При растворении в воде электролиты диссоциируют на положительные и отрицательные ионы, при этом количество носителей и электропроводность раствора возрастают. При малых концентрациях электролита, когда количество ионов мало, увеличение электропроводности пропорционально концентрации растворенного вещества. При увеличении концентрации в результате взаимодействия между ионами и уменьшения степени диссоциации пропорциональность нарушается.
|
| Рис. 5.87. Электролитический преобразователь |
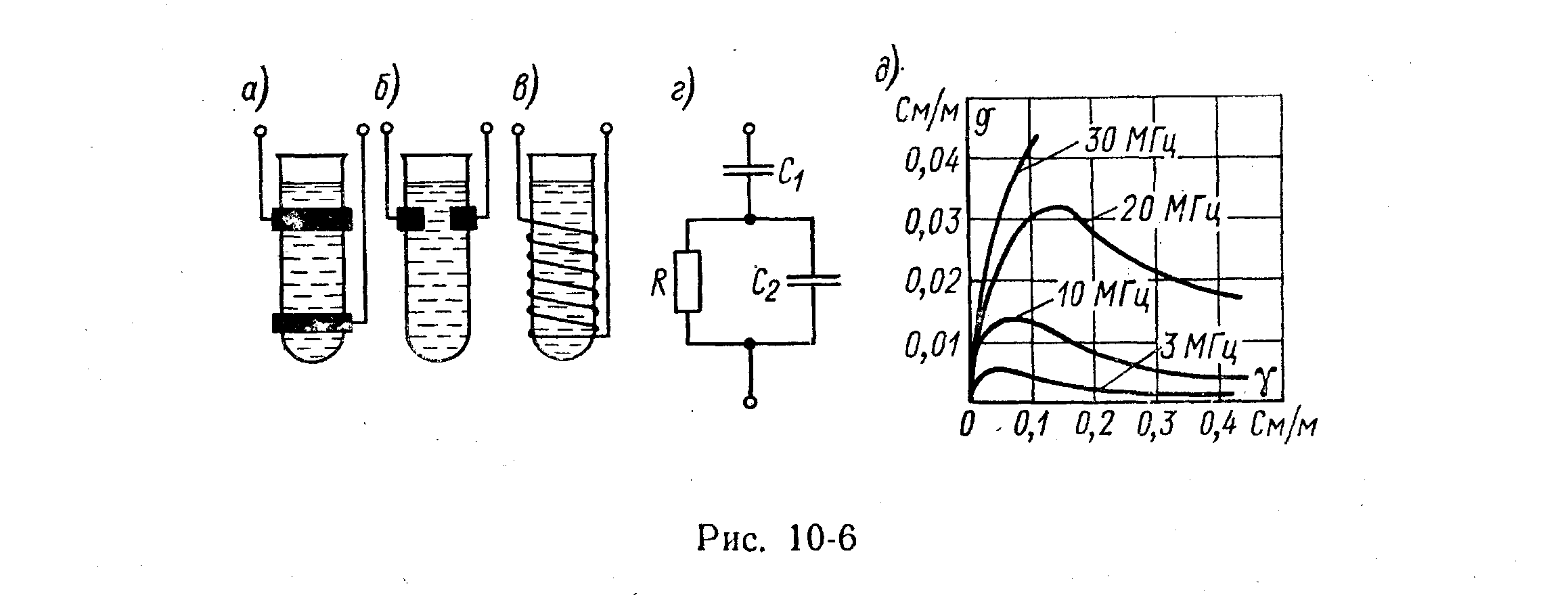
Электролитический преобразователь (рис. 5.87) представляет собой два электрода 1,погруженные в раствор 2. Электролитические преобразователи применяются для измерения концентрации растворов, кроме того, они используются для измерения перемещения, скорости, механических деформаций, температуры и других физических величин. В преобразователях, предназначенных для измерения концентрации, электроды делаются неподвижными. Сопротивление между электродами преобразователя R обратно пропорционально удельной электрической проводимости электролита c:
R=k/ c.
Коэффициент k называется постоянной преобразователя. Он определяется экспериментально по сопротивлению преобразователя, заполненного раствором с известным значением c.
Электрические преобразователи включаются в мостовые измерительные цепи и часто работают с автоматическими мостами. Сопротивление преобразователей сильно зависит от температуры. Для компенсации этой зависимости последовательно с электролитическим преобразователем включаются терморезисторы.
|
|
|
Питание моста с электролитическими преобразователями производится напряжением переменного тока с промышленной частотой или частотой в несколько килогерц. Если электролитические преобразователи питать напряжением постоянного тока, то будет происходить электролиз раствора и изменится его концентрация в приэлектродных областях. Постоянный ток производит также поляризацию электродов. То и другое явления создают погрешность.
| |
| Рис. 5.88. Низкочастотный трансформаторный преобразователь |
Для повышения стабильности преобразователя его электроды должны быть химически инертны по отношения к исследуемому раствору и выполняются из платины, нержавеющей стали или графита. Загрязнение электродов, изменение их активной площади вызывают погрешность.
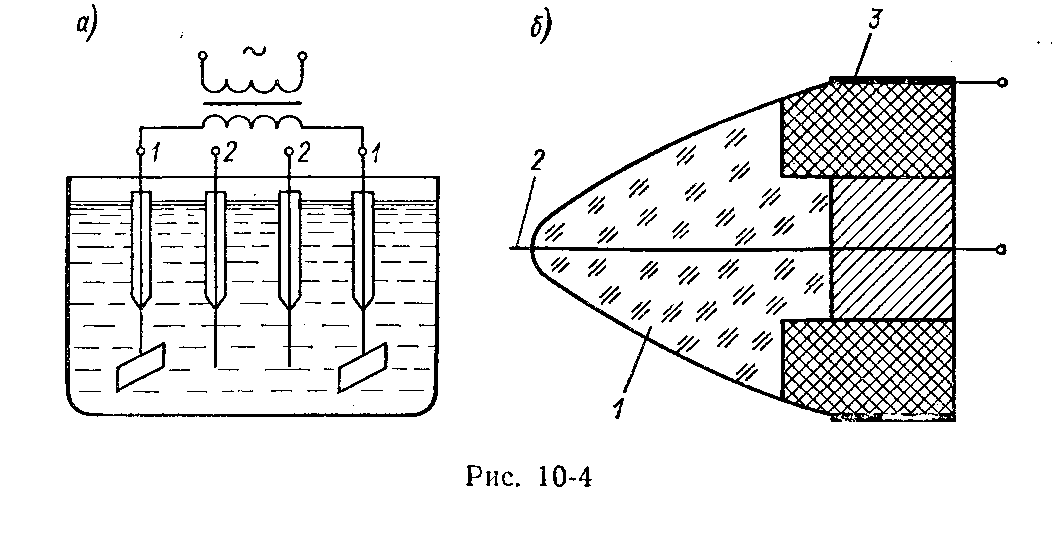
Более надежны бесконтактные электролитические преобразователи, токоведущие элементы которых изолированы от электролита, что исключает поляризацию и другие нежелательные взаимодействия электрода и раствора. Они разделяются на низкочастотные (f £40¸50 кГц) и высокочастотные. На рис. 5.88показан низкочастотный трансформаторный преобразователь с короткозамкнутой вторичной обмоткой. Изменение электропроводности раствора приводит к изменению сопротивления вторичной обмотки и, следовательно, сопротивления первичной обмотки.
|
| Рис. 5.89. Высокочастотные бесконтактные преобразователи емкостные (а, б) и индуктивные (в) |
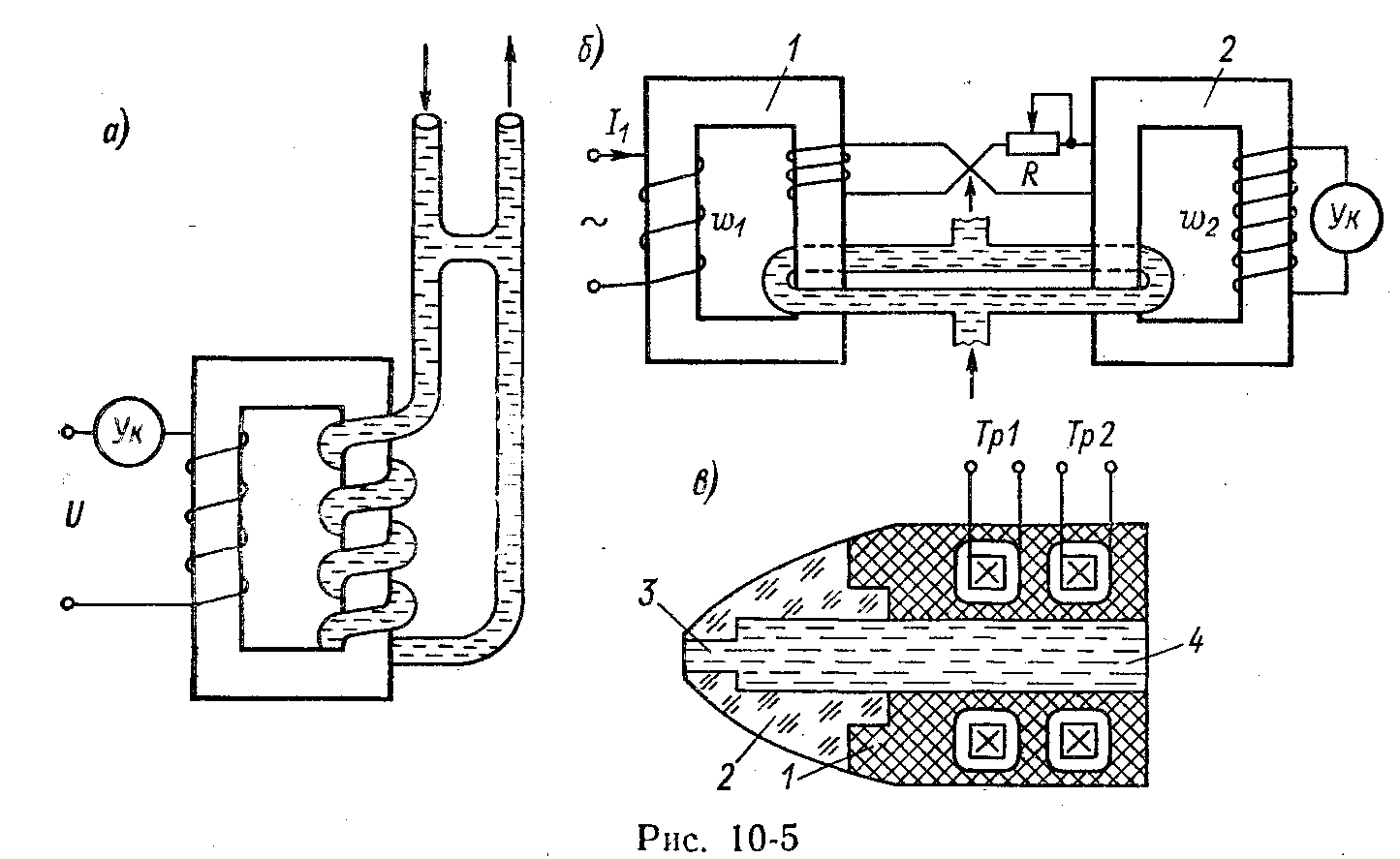
Высокочастотные бесконтактные преобразователи разделяются на емкостные (рис. 5.89, а, б), которые применяются для измерения концентраций растворов с малой электропроводимостью (10–6 – 1 См/м), и индуктивные (рис. 5.89, в) – для растворов с электропроводимостью 10–2–100 См/м. Электроды располагаются снаружи тонкостенной изоляционной трубки с контролируемым раствором. У погружных преобразователей они находятся внутри закрытой трубки, которая помещается в раствор.
|
|
|
Гальванические преобразователи. Принцип действия гальванического преобразователя основан на зависимости потенциала электрода от концентрации ионов в растворе. Металлический электрод, погруженный в раствор электролита, частично в нем растворяется. Положительные ионы металла переходят в раствор, и электрод получает отрицательный заряд. Образованная разность потенциалов между электродом и раствором препятствует переходу ионов металла, и растворение электрода прекращается. При равновесии электрический потенциал электрода зависит от концентрации ионов в растворе и может служить для определения их концентрации.
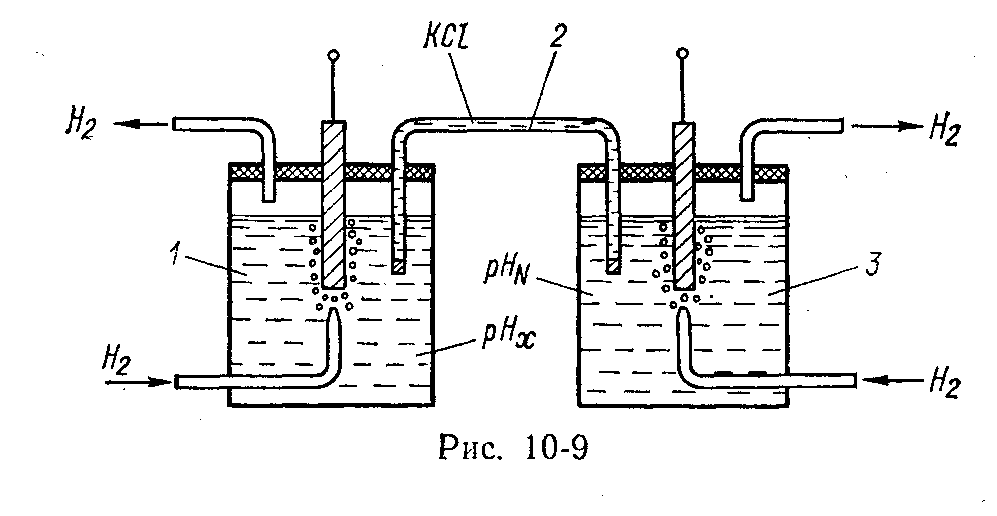
Конструктивно гальванический преобразователь (рис. 5.90) состоит из двух полуэлементов 1 и 3, которые гальванически соединены между собой электрическим ключом 2. Полуэлемент представляет собой сосуд с электролитом с погруженным металлическим электродом. В одном полуэлементе находится раствор, концентрация которого измеряется, в другом – раствор с известной концентрацией. Электролитический ключ – это трубка, заполненная раствором КСl и закрытая с двух сторон полупроницаемыми пробками из ваты или асбеста. ЭДС преобразователя Е, измеряемая между двумя электродами, определяется неизвестной концентрацией.
|
| Рис. 5.90. Гальванический преобразователь |
Большое значение имеет определение концентрации ионов водорода Н + в растворах. Чистая дистиллированная вода диссоциирована на ионы. Согласно закону действующих масс и вследствие малой диссоциации воды ионное произведение воды равно
k=аH + + аOH –,
где аH + и аOH ––концентрация ионов Н + и ОН – в моль/л.
Ионное произведение воды – величина постоянная, при температуре 22°С равна 10–14. Если в воде растворить кислоту, то при диссоциации ее молекул концентрация ионов Н + возрастает и, следовательно, уменьшается концентрация ионов ОН –. Растворение оснований изменяет концентрации Н + и ОН – противоположным образом. Концентрация ионов водорода характеризует кислотность раствора. Кислотность влияет на протекание многих химических реакций и биохимических процессов. Единицей ее измерения служит водородный показатель:
|
|
|
pH =–ln aН +.
Приборы, служащие для измерения водородного показателя, называются рН-метрами. Их первичными преобразователями служат гальванические преобразователи, в которых роль металла играет водород, роль металлических ионов – ионы Н +.
Типичным полуэлементом рН -метра является водородный электрод 1на рис. 5.91. Он представляет стеклянный сосуд с электролитом, в который погружена пластинка, покрытая мелкодисперсной платиной (платиновой чернью) 2. Снизу на пластинку подается газообразный водород. Он адсорбируется платиной и частично в виде ионов Н + переходит в раствор. Вследствие оставшихся на пластинке электронов она имеет отрицательный потенциал относительно раствора. Для измерения кислотности используют два полуэлемента. Один полуэлемент 1заполняется электролитом с известной концентрацией, другой 3 – электролитом, значение рН которого нужно измерить. Развиваемая между электродами разность потенциалов Е определяется выражением
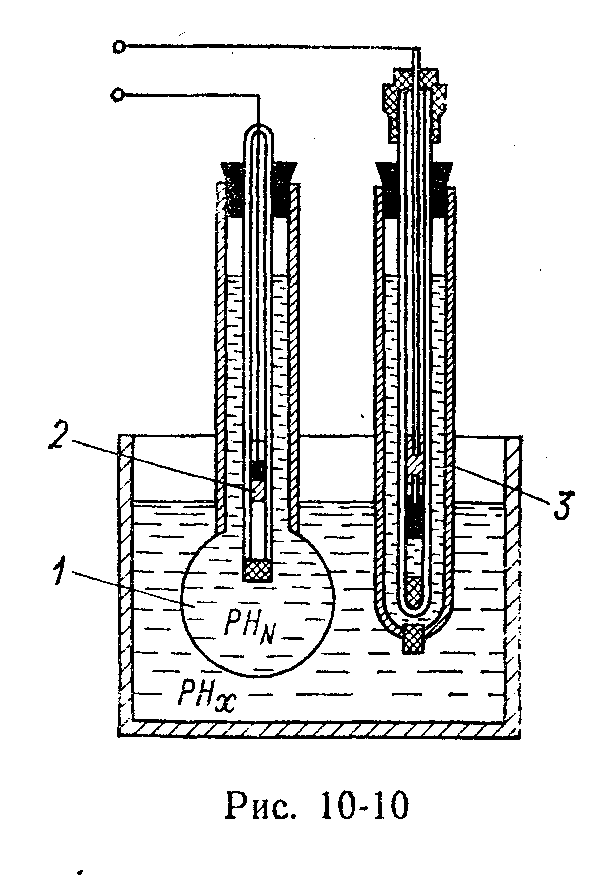
|
| Рис. 5.91. Элемент PH-метра |
E = CT ln[(aH+) x /(a H+)0],
где С – постоянная; Т – температура, К; (aH+) x – измеряемая концентрация ионов Н +; (a H+)0– концентрация ионов Н + образцового раствора.
Если в качестве образцового используется раствор с нормальной концентрацией ионов Н + (1 г/л) и измерение производится при температуре 18° С, то разность потенциалов равна
E 12=0,058 ln(aH+) x = – 0,058 pH.
Водородный электрод позволяет измерять рН в пределах от 0 до 14 с высокой точностью. Однако через преобразователь необходимо пропускать газообразный водород. В настоящее время имеются стеклянный, хлорсеребряный и другие рН -метры, лишенные этого недостатка.
Измерение ЭДС гальванических преобразователей производится при минимальном токе, поскольку при протекании тока происходит электролиз и изменяется концентрация раствора в приэлектродной области, что создает погрешность. При протекании тока происходит падение напряжения на большом внутреннем сопротивлении преобразователя, что также вносит погрешность в измерение ЭДС, которое измеряется либо электронными вольтметрами с большим входным сопротивлением, либо с помощью потенциометров с ручным или автоматическим уравновешиванием. ЭДС гальванического преобразователя зависит от температуры. Для уменьшения погрешности автоматические рН -метры имеют термокорректирующие цепи.
|
|
|
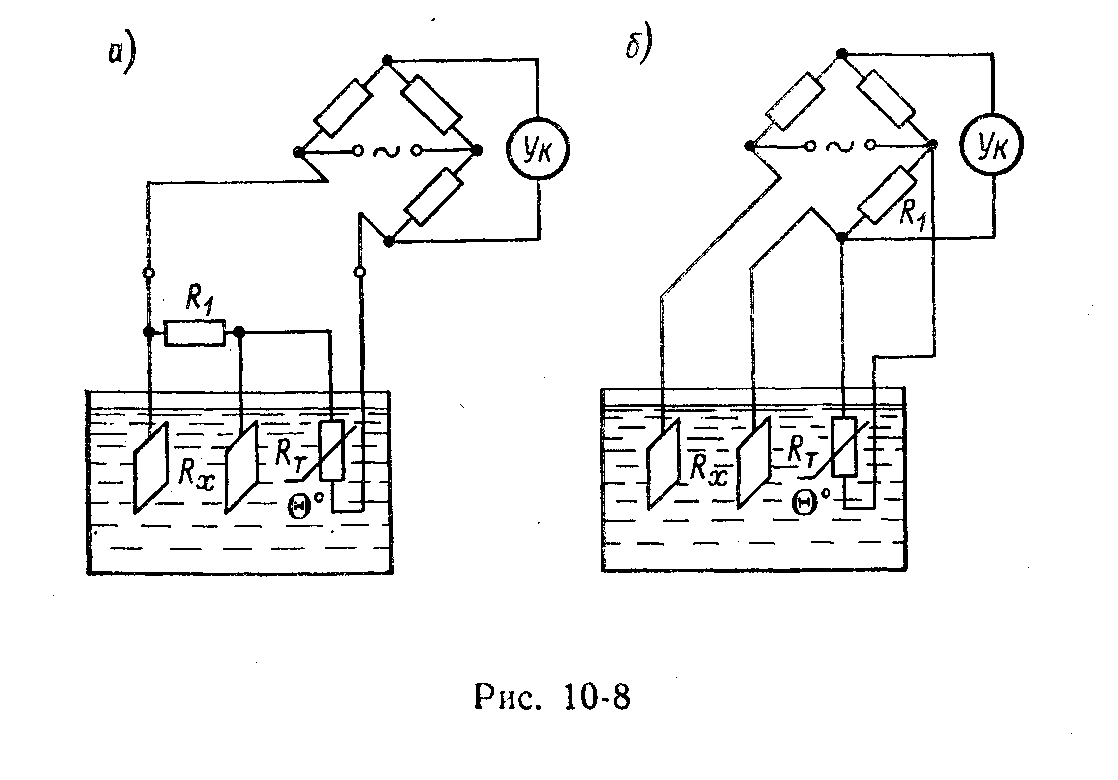
|
| Рис. 5.92. Схемы температурной коррекции с применением медного (а) и полупроводникового (б) терморезисторов |
Коррекция температурной погрешности кондуктометрических преобразователей осуществляется в основном термостатированием раствора и измерительного преобразователя и цепями автоматической коррекции с использованием медных, никелевых, полупроводниковых и электролитических терморезисторов, помещаемых в контролируемый раствор вместе с измерительным преобразователем. На рис. 5.92 показаны схемы температурной коррекции с применением медного (рис. 5.92, а) и полупроводникового (рис. 5.92, б) терморезисторов. Медный терморезистор обычно соединяется последовательно с измерительным преобразователем Rх. Полупроводниковые и электролитические терморезисторы, которые имеют отрицательный ТКС, включаются в плечо моста, смежное с Rх. Для выравнивания ТКС терморезистора и раствора параллельно элементу цепи с большим ТКС включается резистор из манганина R 1.
Контрольные вопросы
1. Дайте определение преобразовательного элемента.
2. Приведите классификацию измерительных преобразователей.
3. Приведите известные Вам структурные схемы средств измерения.
4. Приведите основные параметры и характеристики датчиков.
5. Охарактеризуйте кратко принцип действия и область применения резистивных преобразователей.
6. Охарактеризуйте кратко принцип действия и область применения тензорезисторных преобразователей.
7. Охарактеризуйте кратко принцип действия и область применения емкостных преобразователей.
8. Охарактеризуйте кратко принцип действия и область применения пьезоэлектрических преобразователей.
9. Охарактеризуйте кратко принцип действия и область применения электромагнитных преобразователей.
10. Охарактеризуйте кратко принцип действия и область применения индуктивных преобразователей.
11. Охарактеризуйте кратко принцип действия и область применения трансформаторных преобразователей.
12. Охарактеризуйте кратко принцип действия и область применения индукционных преобразователей.
13. Охарактеризуйте кратко принцип действия преобразователей с распределёнными магнитными параметрами.
14. Охарактеризуйте кратко принцип действия и область применения индуктосинов.
15. Охарактеризуйте кратко принцип действия и область применения вихревых индуктивных преобразователей.
16. Охарактеризуйте кратко принцип действия и область применения магнитоупругих преобразователей.
17. Охарактеризуйте кратко принцип действия и область применения гальванометрических преобразователей.
18. Охарактеризуйте кратко принцип действия и область применения измерителей температуры.
19. Охарактеризуйте кратко принцип действия и область применения оптоэлектрических преобразователей
20. Определите основные понятия и светотехнические величины.
21. Охарактеризуйте кратко принцип действия и основные типы светоэлектрических преобразователей.
22. Охарактеризуйте кратко принцип действия и основные типы фотоэлектрических преобразователей.
23. Охарактеризуйте кратко принцип действия и область применения ионизационных преобразователей.
24. Охарактеризуйте кратко принцип действия и область применения электрохимических преобразователи.
ГЛАВА 6. ИСПОЛНИТЕЛЬНЫЕ УСТРОЙСТВА (МЕХАНИЗМЫ)
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4976; Нарушение авторских прав?; Мы поможем в написании вашей работы!