
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сроки наибольшей информативности ферментных тестов при ИМ
Перспективы медицинской энзимологии
Практически значимыми маркерами гибели миоцитов являются:
ферменты КФК, ЛДГ, АсАТ, гликогенфосфорилаза, изоферменты ЛДГ1 и КФК-МВ (в комплексе с определением концентрации миоглобина, цепей миозина, кардиотропонинов Т и I).
При диагностике ИМ надо учитывать время после ангинозного приступа, т.к. от момента гибели миоцитов до появления в крови маркеров проходит длительное время. Цитозольные ферменты выходят быстрее, структурированные на мембране - медленнее, митохондриальные - самые медленные.
| Фермент | Начало по- Вышения Ак- сти | Max ак-сть | Восстановле- ние до Norma | Степень Max Повышения |
| КФК | 2-4 час | 12-14 час | 1-4 дня | 50 раз |
| ФГИ | 3 час | 12-14 час | 14 дней | 30 раз |
| АсАТ | 6-12 час | 24-36 час | 3-5 дней | 15-30 раз |
| АлАТ | 12-24 час | 24-48 час | 7-14 дней | 15-20 раз |
| ЛДГ | 16-24 час | 36-72 час | 10-12 дней | 20 раз |
Многие наследственные пороки обмена, как оказалось, являются результатом дефекта определенного фермента (фенилкетонурия, муковисцидоз)
Одно из направлений медицинской энзимологии- энзимотерапия- использование ферментов в качестве лекарственных средств:
Гиалуронидаза, эластаза, коллагеназа –при обработке ран. Фибринолитические препараты - борьба с тромбозами.
Препараты-ингибиторы тирозинкиназы С.
Избирательные ингибиторы- трасилол (ингибитор трипсина, химотрипсина и каллекреина при лечении острого панкреатита).
Липосомы- контейнеры для транспорта лекарств.
Фермент тирозинкиназа С -является частью белкового рецептора на мембране клеток. Участвует в передаче апоптического сигнала..Через рецептор в клетке передается сигнал извне. Можно затормозить опухолевый рост путем ингибирования этого фермента.
Препараты-ингибиторы тирозинкиназы С- ZD1839;CP358, 777; SU 101, CGP57148 (по материалам 2-го съезда онкологов стран СНГ, 2000, Киев).
Фермент ароматаза - активируется при раке молочной железы, катализирует превращение тестостерона в эстрадиол- разработаны ингибиторы ароматазы- аромазин (экземестан) и др.
Tag-ДНК - полимераза -ПЦР
Каспазы - имеют значение при апоптозе, катализируют фрагментацию ДНК опухолевых клеток
Исследованию ферментов большое внимание уделялось на
33 FEBS Congress 28 июня-3 июля 2008 года в Афинах (Греция)
Тема конгресса «Биохимия клеточной регуляции»
Ферменты, работающие в соединительной ткани
В связи с проблемой изучения опухолевого роста, инвазии опухолей
Металлопротеиназы (ММР)
Коллагеназы I типа- ММР1, ММР-8, ММР-13
Коллагеназы IV типа-желатиназы- ММР-2, ММР-9
Эластазы- ММР-12 и др.
Гепараназа
Гепариназа
Гиалуронидаза
КЛИНИЧЕСКАЯ ЗАДАЧА -1.
У больного выявлено повышение активности изоферментов лактатдегидрогеназы (ЛДГ) - ЛДГ1,ЛДГ2, аспартатаминотрансферазы (АсАТ), креатинфосфокиназы (КФК). В каком органе (органах) возможно развитие патологического процесса?
- *в сердечной мышце (начальная стадия инфаркта миокарда)
- в скелетных мышцах (дистрофия, атрофия)
- в почках и надпочечниках
- в соединительной ткани
- в печени и почках
РЕГУЛЯЦИЯ МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ: РЕГУЛЯТОРНЫЕ ФЕРМЕНТЫ. КОФАКТОРЫ И КОФЕРМЕНТЫ. КОФЕРМЕНТНЫЕ ФУНКЦИИ ВИТАМИНОВ.
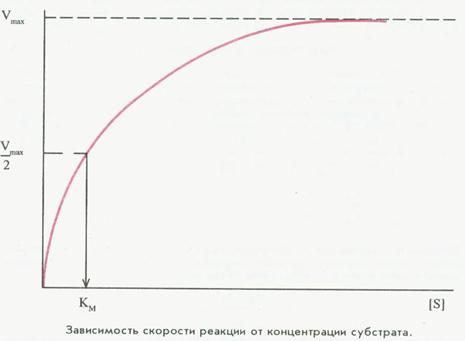
Кинетика ферментативных реакций - раздел энзимологии, который изучает зависимость скорости реакции от химической природы реагирующих веществ (фермента, субстрата) и условий их взаимодействия.
зависимость скорости ферментативной реакции от концентрации субстрата - при рассмотрении этого свойства следует учитывать эффект насыщения фермента субстратом.
Михаэлис и Ментен- изучали явление насыщения, разработали общую теорию ферментативной кинетики, п остулировали образование промежуточного фермент-субстратного комплекса ЕS.
Математическая обработка – уравнение и график Михаэлиса-Ментен.
Ученые Бриггс и Холдейн учли влияние продукта реакции
Лайнуивер и Бэрк преобразовали уравнение Бриггса-Холдейна по методу двойных обратных величин

Регуляция активности ферментативных процессов: активация и ингибирование.
Регуляция активности ферментов может осуществляться с помощью эффекторов- химических соединений, которые ускоряют ферментативные реакции (активаторы) или тормозят их (ингибиторы).
Механизмы активации ферментов
1) путем частичного расщепления;
2) путем присоединения кофактора (кофермента);
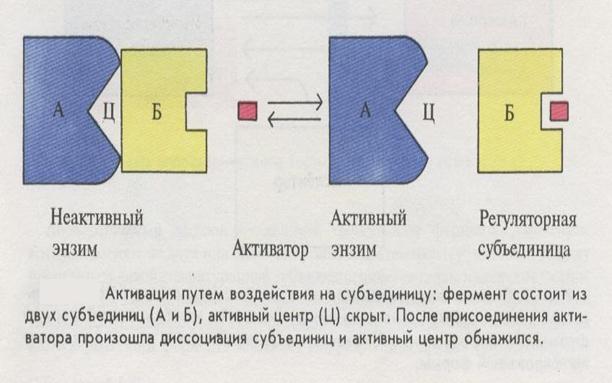
3) путем воздействия на субъединицы молекулы фермента
4) путем химической модификации
5) регуляция активности ферментов по принципу обратной связи
6) другие механизмы: конкуренция ферментов за общий субстрат, выключение активности одного из изоферментов, компартментализация.
Механизм активации ферментов путем частичного расщепления.
Часть ферментов секретируется в виде неактивных зимогенов.
HCl желудочного сока -неактивный пепсиногена в активный пепсин.
Под влиянием энтерокиназы тонкого кишечника -трипсиноген в трипсин

Механизм активации путем присоединения кофактора (кофермента).
Для многих ферментативных реакций необходим кофактор- простой металл: Fe++, Fe+++ - активирует цитохромоксидазу, каталазу, пероксидазу;
Mn++ - аргиназу, изоцитратдегидрогеназу;
Zn++ - ЛДГ;
Mg++ - щелочную фосфатазу, Г-6-ФДГ-зу, гексокиназу;
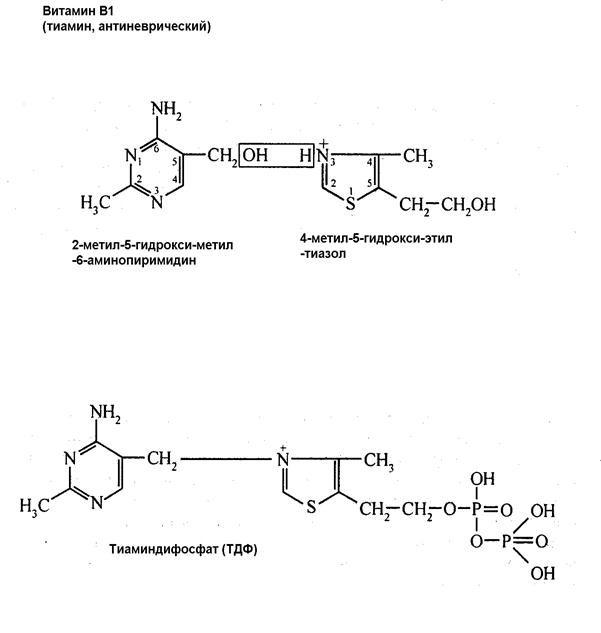
В качестве кофакторов (коферментов) могут выступать производные витаминов. Например, тиаминпирофосфат- производное витамина В1 тиамина (антиневрического)- кофактор ферментов углеводного обмена- ПВДГ, альфа-КГДГ, транскетолазы.
Отсутствие В1 (или недостаток) вызывает накопление пирувата в мозге, крови и других жидкостях и приводит к расстройству ЦНС и периферической НС.
Механизм активации фермента путем воздействия на субъединицы молекулы фермента
Механизм активации фермента путем химической (структурной) модификации- ряд белков при формировании третичной структуры подвергается постсинтетической модификации (ключевые ферменты энергетического обмена- фосфорилаза, гликогенсинтаза и др.- контролируются путем фосфорилирования и дефосфорилирования).
Механизм регуляции активности фермента- по принципу обратной связи
Допустим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом: А…. Е1, Е2, Е3, Е4….. Р. Скорость подобной суммарной последовательности реакций может определяться концентрацией предшественника (А)- активация предшественником, а может -концентрацией конечного продукта (Р)- ингибирующее действие на первую стадию процесса, фермент Е1.
6. Ингибирование ферментов- в зависимости от механизма торможения ферментативной активности делится на:
Обратимое необратимое
встречается чаще стойкие изменения
/ \ модификация групп
Конкурентное(изостерическое) Неконкурентное(аллостерическое)
ингибирование соединениями, ингибирование соединениями,
структура которых сходна которые связываются с ферментом
со структурой субстрата вне активного центра
связываются с активным центром Тяжелые металлы- SH-гр.
Малоновая кислота –ингибитор СДГ цистеиновых ферментов.
СООН -СН2 – СООН Цианиды связывают ЦО-зу,
Янтарная кислота- субстрат нет стуктурного сходства с S,
СООН -СН2 СН2- СООН прочное соединение с Fe3+
Сульфаниламиды- аналоги ПАБК, фермента, дыхание подавлено
которая нужна для синтеза на 90%
фолиевой кислоты кокков
Обратимое ингибирование можно выразить как: E+I↔EI
Конкурентное ингибирование E+I↔EI
Неконкурентное ингибирование: E+I↔SEI
Необратимое ингибирование: E+I→EI – процесс, который происходит при разрушении или необратимой химической модификации функциональных групп фермента. По такому принципу действуют клеточные яды, например, йодацетамид IСH2-СО-NН2 необратимо реагирует с SH-группами активного центра; ФОС (фосфорорганические соединения) взаимодействуют с ацетилхолинэстеразой.
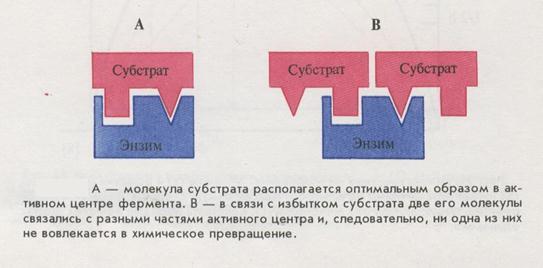
Ингибирование избытком субстрата- предположительно, молекулы субстрата при его избытке способны занимать неправильное положение в активном центре
5. Коферментные функции витаминов.
Коферменты (коэнзимы)- биоорганические соединения небелковой природы, необходимые для действия фермента, т.е. для превращения субстрата в каталитическом процессе.
КЛАССИФИКАЦИЯ КОФЕРМЕНТОВ
|
|
Дата добавления: 2014-11-29; Просмотров: 404; Нарушение авторских прав?; Мы поможем в написании вашей работы!