
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАКОН ГЕССА 3 страница
|
|
|
|
& ТИМ, ХТО ХОЧЕ ЗНАТИ БІЛЬШЕ
Термодинаміка біохімічних процесів
Закони термодинаміки справедливі для будь-яких систем, в тому числі й біологічних. Але при їх використанні для таких об'єктів є певна специфічність і значні ускладнення. Перш за все біологічні системи — це відкриті системи, які безперервно обмінюються речовиною та енергією з навколишнім середовищем, і ці процеси проходять в стаціонарному режимі. Крім того, ці системи функціонують в умовах більшого чи меншого віддалення від стану хімічної рівноваги. Адже будь-яка клітина в стані хімічної рівноваги – це мертва клітина.
Перетворення енергії, яке відбувається в процесі обміну речовинами в живому організмі є предметом біоенергетики. Розділ термодинаміки біологічних процесів, який називають біоенергетикою, дуже складний і наразі ще недостатньо розроблений.Ці перетворення здійснюються в повній відповідності із першим і другим законами термодинаміки. Але живий організм має ряд відмінних специфічних особливостей у порівнянні з системами, які служать об'єктами вивчення в технічній і хімічній термодинаміці. Розглянемо ці особливості.
1. Живий організм є типовою відкриттю системою, що безперервно обмінюється з навколишнім середовищем і речовиною і енергією.
2. Застосування II закону термодинаміки до живих організмів неможливе без врахування впливу біологічних закономірностей. Характер зміни ентропії, що має вирішальне значення при оцінюванні процесів в неживих системах, має в біологічних системах лише підлегле значення.
3. Всі біохімічні пронеси, що відбуваються в клітинах живих організмів, відбуваються в умовах сталості температури і тиску, при відсутності значних перепадів концентрації, різкої зміни об'єкта.
|
|
|
Основним джерелом енергії для організму є хімічна енергія, що міститься в харчових продуктах. З їжею в організм потрапляють досить складні високомолекулярні сполуки, які мають багато слабких хімічних зв'язків. Такі речовини характеризуються невеликим значення ентропії S, високим значення енергії Гіббса G, також ентальпії H.
У процесі засвоєння їжі із відносно великих молекул вуглеводів, білків, жирів утворюються нові молекули з більш простою структурою і більш міцними хімічними зв'язками між атомами (СО2, Н2О, СО(NH2)2).
Для практичних цілей найширше використовують наслідок першого закону термодинаміки — закон Гесса. Визначення калорійності їжі чи кормів виконують методом калориметрії (спалювання в калориметричних бомбах). Тепловий ефект реакції спалювання цукру, визначений в калориметричній бомбі, рівний сумі теплових ефектів багатостадійного процесу перетворення цукру в живому організмі до тих же кінцевих продуктів — СО2 і Н2О.
Звісно, що процес розкладу (диссимиляції) речовини, при якому із меншого числа частинок утворюється більше, призводить до збільшення ентропії (ΔS>О), а також до того, що вході цього перетворення зміцнюються хімічні зв'язки і реалізується хімічна спорідненість. Енергія Гіббса системи зменшується (ΔG < О).
Величина енергії Гіббса у продуктів життєдіяльності є значно нижчою, ніж у вихідних продуктів харчування. Аналогічні зміни відбуваються і з ентальпією системи (ΔН < О).
Важливо зауважити, що у живих системах вивільнення енергії при розщепленні органічних сполук може здійснюватись як за участю кисню (аеробне окиснення), так і без нього (анаеробне розщеплення). Причому в обох випадках частина енергії зразу ж може виділятися в навколишнє середовище у вигляді тепла, а інша частина — акумулюватись у так званих макроергічних зв'язках фосфоровмісних органічних сполук (аденозинтрифосфорна кислота, фосфоенолпіровиноградна кислота, карбамілфосфат тощо).
|
|
|
В організмі тварин (насамперед теплокровних) єнизка речовин, які здатні впливати не тільки на інтенсивність розщеплення тієї чи іншої органічної речовини, а й на співвідношення тих часток енергії, які виділяються у вигляді тепла чи акумулюються у макроергічних сполуках. Як правило, такими природними речовинами-регуляторами є сполуки, які називаються гормонами (тироксин — гормон щитовидної залози, інсулін та глюкагон — гормони підшлункової залози тощо). Завдяки їх регуляторним впливам забезпечується сталість температури тіла теплокровних тварин. Є також група речовин, які здатні практично повністю блокувати процеси акумуляції енергії, що виділяється, в макроергічних зв'язках і тоді вона майже повністю виділяється у вигляді теплової енергії. Як правило, ці речовини відносять до надзвичайно сильних отрут (солі синильної кислоти тощо).
Складніші проблеми виникають при застосуванні другого закону термодинаміки. Як в хімічному реакторі, так і в живому організмі термодинамічно заборонені процеси реалізуватись не можуть. Проте в ізольованому реакторі самовільно протікають процеси тільки в напрямку наближення до стану рівноваги, що супроводжується збільшенням хаотичності в системі і зростанням ентропії. У живих організмах поряд з процесами дезагрегації, які ідуть із зростанням ентропії, протікають і процеси впорядкування, коли ентропія зменшується. Така можливість зумовлена поглинанням живим організмом необхідної енергії з навколишнього середовища. Проте сумарна ентропія системи "живий організм + середовище" завжди зростає.
Розглянемо, для прикладу, зміну ентропії енергії Гіббса і ентальпії системи в процесі засвоєння в організмі людини сахарози, який зводиться до її окислення:
СІ2Н22011 (к) + 11О2(г) = 12СО2(г) + 11Н2О
Розрахуємо зміну ентропії за рівнянням:
ΔS0298 = ∑S0298 (прод.) - ∑S0298 (вих.)
ΔS0298 = [12ΔS0298 (CO2) + 11ΔS0298 (H2O)] – [S0298 (CІ2Н22011) + 11S0298 (O2)]
ΔS0298 = (12∙213,82 + 11∙70,4) – (359,824 + 205,03) = 720,69 (Дк/моль∙К)
Розрахуємо зміну енергії Гіббса за рівнянням:
ΔG = Σ (ΔGзвор.) кінц __ - Σ (ΔGзвор.) вих.
|
|
|
ΔG0298 = [І2ΔG0298(СО2) + 11ΔG0298(Н2О)] - [ΔG0298(С12Н22О11) + 11ΔG0298(О2)]
ΔG0298 = (12 ∙ (-394,644) – 11 ∙ 237,404) + 1529,67 + 11∙ 0 = -2565,84 – 2611,444 + 1529,67 = -3657,61(кДж/моль)
Розрахуємо зміну ентальпії за рівнянням:
ΔН0298 хім.реак. = ∑Н0298 згор.(вих.) - ∑Н0298 згор. (прод.)
ΔН0298 = [12ΔН0298 (СО2) + 11ΔН0298 (Н2О)] - ΔН0298 (СІ2Н22011)
ΔН0298 = (12∙ (-393,78) - 11∙ 286,02) + 2220,867= - 4725,36 – 3146,22 +2220,867 = - 5650,713(кДж/моль)
Виходячи із значення ΔН сахарози, її молярної маси (М = 342,3 г/моль), бачимо, що її питома калорійність буде становити:
5650,713 кДж/моль: 342,3 г/моль = 16,51 кДж/г
Такий же характер зміни величини ентропії, енергії Гіббса і ентальпії має місце в процесі засвоєння білків і жирів.
Таблиця 1.4.
Калорійність і вміст поживних речовин у продуктах харчування
| Продукти | Загальна калорійність | Вміст, % | Вміст вітамінів і мінеральних речовин, мг | ||||||
| білки | вуглеводи | жири | вітамін А | вітамін С | вітамін В | ССа | FFе | ||
| Какао, ¾ стакана (188г) | 11,8 | 00,077 | 00,59 | ||||||
| Сметана. 1 ст. ложка (12г) | 00,1 | 00,004 | 00,1 | ||||||
| Йогурт, 1 стакан (222г) | 11,36 | 00,077 | 00,14 | ||||||
| Молоко, 1 стакан (244г) | 22,29 | 00,093 | 00,12 | ||||||
| Яєчня. з 1 яйця (46г) | 00,033 | 00,92 | |||||||
| Яблуко (138г) | 1,3 | 00,04 | 00,4 | ||||||
| Банан (119г) | 11,7 | 00,06 | 00,8 | ||||||
| Буряк 1/2стакана (83г) | 00,01 | 00,6 | |||||||
| Морква. 1/2стакана (73г) | 00,04 | 00,4 | |||||||
| Ананас (122г) | 1,5 | 00,9 | 00,1 | 11,3 | 00,4 |
´ Контрольні запитання
1. Які питання вирішує термодинаміка?
2. Які принципові питання розглядає хімічна термодинаміка?
3. Дайте визначення системи.
4. Наведіть класифікацію систем за характером взаємодії з навколишнім середовищем.
5. Що називається параметрами стану?
6. Що називається термодинамічним процесом?
7. Дайте різні формулювання першого закону термодинаміки.
8. В якому співвідношенні знаходяться ентальпія і внутрішня енергія системи?
9. Які умови називаються стандартними?
10. Чим відрізняються термохімічні рівняння від хімічних?
|
|
|
11. Що таке стандартна ентальпія утворення?
12 Сформулюйте закон Гесса.
13. Поясніть наслідки закону Гесса, наведіть відповідні приклади.
14. Обчисліть стандартну теплоту утворення бензолу з простих речовин, якщо ентальпія згоряння бензолу ΔН озгор.(С6 Н6) = - 3267,6 кДж/моль, а ентальпія утворення оксиду вуглецю (IV) і води відповідно рівні ΔНоутв.(СО2) = - 393,51 кДж/моль і ΔНоутв.(Н2О) = - 281 кДж/моль.
15. Обчисліть при температурі 298К і тиску 101,3 кПа тепловий ефект ΔН° реакції: Fе2О3 + 2А1 = А12О3 + 2Fе,
якщо відомо:
ΔНоутв(Fе2О3) = -822,5 кДж/моль;
ΔН0утв.(А12О3) = - 670,6 кДж/моль.
16. Якими довідниковими величинами користуються для розрахунку теплового ефекту реакції?
17. Що таке калорійність?
18. Сформулюйте другий закон термодинаміки.
19 Що таке ентропія?
20. Як змінюється ентропія системи при розширенні газу? При утворенні кристалів у насиченому розчині?
21. Які термодинамічні фактори визначають направлення хімічних реакцій?
22. Яке значення повинна мати енергія Гіббса для реакцій, що самодовільно відбуваються?
23 Яке значення має ізобарно-ізотермічний потенціал у рівноважній системі?
24. Як розрахувати зміну енергії Гіббса для хімічної реакції?
25. В чому полягає особливість живих організмів як об'єктів термодинамічних досліджень?
26. Творче завдання: Підготувати розповідь з теми: «Яким було б життя, якби людство не знало законів фізичної хімії»
J Тест на тему "Основи хімічної термодинаміки"
| Питання | Варіанти відповіді |
| 1. Ентропія ізольованої системи | а)...зменшується і в стані рівноваги набуває свого мінімального значення; б)...збільшується і в стані рівноваги набуває свого максимального значення; в)... зменшується і в стані рівноваги набуває свого максимального значення; г)... збільшується і в стані рівноваги набуває свого мінімального значення. |
| 2. Основні параметри хімічної термодинаміки: | а) об'єм, маса, температура, моляльність; б) тиск, об'єм, температура, концентрація; в) молярна маса, тиск, концентрація, кількість теплоти; г) температура, об'ємна частка речовини, моль, стандартна ентальпія. |
| 3. Перший закон термодинаміки: | а) А=Р(V2 – V1) в) ΔU = Q - A б) Q = ΔH г) Q = CmΔt. |
| 4. Енергія Гіббса розраховується за формулою: | а) G =ТΔS + ΔH; г) G = ΔH- ТΔS; б) G = ΔH - S; д) G = ΔS -ТΔH. в) G = TΔS - ΔH; |
| 5. Енергію Гельмгольца розраховують за формулою: | а) F = ΔS - ТΔH б) F = ΔU - ΔS; в) F = ΔU – ТΔS г) F= ТΔS - ΔU д) F = U + ТΔS. |
| 6. Другий закон термодинаміки: | а) “Самодовільно можуть відбуватися лише такі процеси, у резу-льтаті яких вирівнюються ті або інші фактори інтенсивності”; б) “Самодовільно можуть відбуватися лише такі процеси, у ре-зультаті яких вирівнюються ті або інші фактори екстенсивності”; в) “Самодовільно можуть відбуватися лише такі процеси, у резу-льтаті яких не вирівнюються ті або інші фактори екстенсивності”. |
| 7. Ентропію вимірюють: | а) (S) = 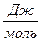 ; б) (S) = ; б) (S) = 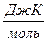 ; в) ; в) 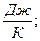 г) г) 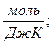 д) д) 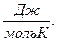
|
| 8. Ізохорно-ізотермічний потенціал в хімічних реакціях розраховують за рівнянням: | а) ΔG = 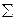 (ΔGутв.)вих - (ΔGутв.)вих - 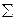 (ΔGутв.)кін.;
б) ΔG = (ΔGутв.)кін.;
б) ΔG = 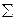 (ΔGутв.)вих + (ΔGутв.)вих + 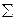 (ΔGутв.)кін.;
в) ΔG = (ΔGутв.)кін.;
в) ΔG = 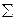 (ΔGутв.)кін - (ΔGутв.)кін - 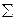 (ΔGутв.)вих.;
г) ΔG = (ΔGутв.)вих.;
г) ΔG = 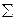 (ΔGутв.)кін + (ΔGутв.)кін + 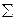 (ΔGутв.)вих. (ΔGутв.)вих.
|
| 9. Екстенсивні величини: | а) об'єм, теплоємність, тиск, температура; б) маса, об'єм, теплоємність; в) тиск, маса, ентальпія, концентрація. |
| 10. Хімічна термодинаміка... | а) вивчає хімічні і фізичні процеси, але не торкається механізмів реакцій; б) вивчає хімічні процеси і торкається механізмів реакції; в) вивчає лише сумарні результати реакцій залежно від заданих умов. |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 672; Нарушение авторских прав?; Мы поможем в написании вашей работы!