
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тиск пари над розчинами. Закон Рауля
|
|
|
|
При випаровуванні рідини над її поверхнею утворюється пара. Процес випаровування зворотний, одночасно з ним йде і конденсація пари. При рівності швидкостей випаровування і конденсації встановлюється динамічна рівновага і насичена пара при даній температурі має сталий тиск.
З підвищенням температури тиск насиченої пари збільшується.
Тиск насиченої пари розчинника над розчином завжди менший, ніж над чистим розчинником.
Чим більша концентрація розчину, тобто чим менше молекул розчинника міститься в одиниці об’єму, тим менший тиск насиченої пари.
Отже, тиск насиченої пари розчинника над розчином пропорційний молярній частці розчинника А:
Ра = к ∙Nа ,
де Ра - тиск насиченої пари розчинника над розчином;
Nа – молярна частка розчинника.
Якщо прийняти, що Nа = 1, тобто розчиненої речовини немає, то к буде дорівнювати тиску насиченої пари над чистим розчинником Роа , або к = Роа
Тоді: Ра = Роа∙ Nа (2.1)
Згідно цього рівняння:
Тиск насиченої пари розчинника над розчином дорівнює добутку його тиску над чистим розчинником на молярну частку розчинника.
Цей закон називається законом Рауля. У 1887 році французький фізик Рауль вивів цей закон, вивчаючи розчини різних нелетких рідин і твердих тіл.
Рівняння (2.1) можна представити в іншому вигляді. Молярну частку розчиненої речовини В позначимо через Nв, тоді
Nа + Nв = 1 і Nа = 1 – Nв.
Підставивши цей вираз в рівняння (2.1), одержимо:
Ра = Рао (1 - Nв), або
Рао - Ра = Рао Nв.
Розділивши останнє рівняння на Рао, одержимо:
Відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини.
Це другий варіант формулювання закону Рауля.

 Р
Р 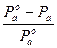 = Nв (2.2)
= Nв (2.2)
|
|
|
 Залежність парціального тиску пари компонента від складу є прямою лінією, яка проходить через початок координат (Рис. 9). Розчини, що підкоряються закону Рауля називають ідеальними.
Залежність парціального тиску пари компонента від складу є прямою лінією, яка проходить через початок координат (Рис. 9). Розчини, що підкоряються закону Рауля називають ідеальними.
N
Рис. 9. Залежність парціального тиску пари компонента від складу.
Чим більше розбавлений розчин, тим краще він підпорядковується закону Рауля і тим він ближчий до ідеального. З ростом концентрації розчину збільшується відхилення його від ідеального стану.
Відносне зниження тиску пари розчинника над розчином Ф.Рауль (1882) встановив на підставі численних експериментальних даних. Воно справджується для розчинів, коли розчинник леткий, а розчинена речовина нелетка.
6. ТЕМПЕРАТУРА КРИСТАЛІЗАЦІЇ І КИПІННЯ РОЗЧИНІВ
На відміну від чистої рідини розчин при охолодженні не замерзає повністю при постійній температурі. При певній температурі з розчину починають виділятися кристали розчинника і, по мірі охолодження, кількість їх зростає до тих пір, поки весь розчин за кристалізується.
Температурою кристалізації (замерзання) розчину вважають температуру, при якій починається утворення кристалів.
Замерзає рідина при тій температурі, при якій тиск пари речовини в твердому стані стає рівним тиску пари цієї ж речовини в рідкому стані. Наприклад, тиск пари льоду і тиск пари води однаковий і дорівнює 46мм рт.ст. при 00С, тому 00С вважається температурою замерзання води. Якщо ж взяти розчин якої-небудь речовини у воді, то в зв’язку з пониженням тиску пари при 00С він буде мати менший тиск пари, ніж чиста вода. Так, наприклад, розчин, що містить 10г солі NaCl в 100г води, замерзає при температурі -13,60С, морська вода замерзає при температурі -2,50С і т.д.
При кристалізації розчинів кристали розчинника знаходяться в рівновазі з розчином і тиск пари над кристалами розчинника, і тиск пари над розчином повинен бути однаковим.
На рис. 10 представлена фазова діаграма води, яка доповнена кривою ВЕ, що характеризує тиск пари води над розчином нелеткої речовини. Ця крива розташовується нижче кривої СD – кривої тиску насиченої пари чистої води.
|
|
|
В точці B тиск пари льоду дорівнює тиску пари над розчином. Температура, що відповідає цій точці, буде температурою замерзання розчину (Тзам.).
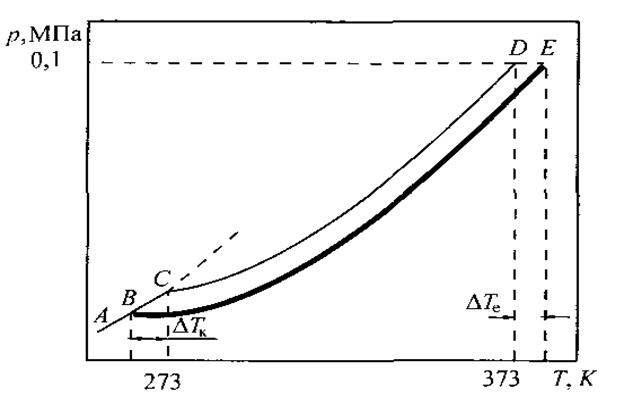
Розчин замерзає при більш низьких температурах, ніж чистий розчинник. Із збільшенням концентрації розчину температура замерзання знижується.
Рис.10. Залежність пружності насиченої пари води від температури над льодом (крива АС), водою (крива СД) і водним розчином (крива ВЕ)
Вивчаючи замерзання і кипіння розчинів, Рауль встановив:
Підвищення температури кипіння і зниження температури замерзання розведених розчинів неелектролітів пропорційне моляльній концентрації розчину.
Δ Тзам = Кзам∙m (2.3)
де m - моляльна концентрація розчину, моль/кг;
Кзам - кріоскопічна стала.
Якщо прийняти m = 1, то Тзам=Кзам. Отже, коефіцієнт Кзам дорівнює зниженню температури замерзання розчину, в якому на 1 моль розчиненої речовини приходиться 1кг розчинника. Для кожного розчинника цей коефіцієнт постійний і не залежить від природи розчиненої речовини. Її називають кріоскопічною сталою (від грецьк. “кріос” – холод). Кріоскопічна стала води Кз Н2О = 1,86.
Кріоскопічна стала розчинника або молярне зниження температури замерзання чисельно дорівнює зниженню температури замерзання в одномоляльному розчині з властивостями ідеального.
Метод вивчення властивостей розчинів, який базується на вимірюванні температури їх замерзання, був розроблений Бекманом і одержав назву кріоскопії.
Розчин кипить при температурі вищий, ніж чистий розчинник. Із збільшенням концентрації розчину температура кипіння підвищується.
Підвищення температури кипіння прямо пропорційне його моляльності m:
Δ Ткип = Ккип ∙ m (2.4)
Коефіцієнт Ккип - ебуліоскопічна стала (віл лат. “ебуліо” – кипіти). Ебуліоскопічна стала залежить тільки від природи розчинника і не залежить від природи розчиненої речовини.
Одномоляльний розчин будь-якого неелектроліта у воді при нормальному атмосферному тиску буде кипіти при 100,513оС, тобто ебуліоскопічна стала воли Ккип. н2О = 0,513о.
|
|
|
Ебуліоскопічна стала розчинника або молярне підвищення температури кипіння чисельно дорівнює Δ Ткип при моляльній концентрації 1моль/кг, якщо розчин при цій концентрації має властивості ідеального.
Метод дослідження властивостей розчинів, який базується на визначенні температури їх кипіння, називається ебуліоскопією.
Константи Ккип і Кзам постійні для кожного розчинника і не залежать від природи розчиненої речовини (табл.1.6)
На зміні пониження температури замерзання або підвищення температури кипіння оснований один з методів визначення відносної молекулярної маси. Рівняння (2.3) і (2.4) можна записати в загальному вигляді:
Δ Т = К m
Моляльність розчину розраховують за формулою:
m = 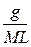
 . 1000,
. 1000,
де g- маса розчиненої речовини, г;
L - маса розчинника, г;
M – молярна маса розчиненої речовини.
Тоді об’єднавши цих два рівняння, матимемо:
Δ Т = 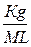
 . 1000 або М =
. 1000 або М = 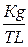
 . 1000 (2.5)
. 1000 (2.5)
Таким чином, за рівнянням (2.5) можна розраховувати молярну масу розчиненої речовини, якщо відомо пониження температури замерзання або підвищення температури кипіння розчину певної концентрації.
На зниженні температури замерзання рідин при розчиненні в них нелетких речовин ґрунтується дія антифризів.
Антифризи – речовини, додавання яких знижує температуру замерзання розчину.
Завдяки тому, що температура замерзання розчинів нижча, ніж температура замерзання ідеальних рідин, розчини використовують як хладоносії – рідини, які охолоджують до низьких температур і подають по трубам до місця споживання холоду.
Для цієї мети використовують розчини NaCl, CaCl2, етиленгліколю, але вони викликають корозію труб. Тому найкраще використовувати водні розчини пропиленгліколю, їх температура замерзання нижча –50оС і вони не виявляють корозійної активності.
Такі біологічні рідини, як молоко і кров, які є багатокомпонентними розчинами, замерзають при температурі нижче 0оС. Температура
замерзання нормального коров’ячого молока знаходиться в межах від (-0,54) до (-0,58)оС. Відхилення від цієї температури вказує на розведення молока водою.
|
|
|
Таблиця 1.6
Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
| Розчинник | Кк, град/моль | Ке, град/моль |
| Вода | 1,86 | 0,52 |
| Бензол | 5,12 | 2,64 |
| Оцтова кислота | 3,90 | 2,93 |
| Етанол | - | 1,23 |
7. ФАЗОВІ ПЕРЕХОДИ. ФАЗОВА РІВНОВАГА
В даній темі розглядаються закономірності переходу речовини з однієї фази до іншої. Знання цих закономірностей необхідне, наприклад, при розробці оптимальних умов зберігання товарів, для застосування фізико-хімічних методів, зокрема методу екстракції, при оцінці якості продовольчої сировини та товарів.
Процеси, що відбуваються в природі та промисловості, можуть супроводжуватись переходом речовини з одного агрегатного стану в інший. Такі процеси називають фазовими переходами. Розглянемо основні фазові переходи.
Випаровування – перехід рідини в газоподібний стан.
Конденсація – перехід речовини із газоподібного стану в рідкий.
Сублімація – перехід речовини із твердого стану в газоподібний.
Десублімація – перехід речовини із газоподібного стану в твердий.
Плавлення – перехід речовини із твердого стану в рідкий.
Кристалізація – перехід речовини із рідкого стану в твердий.
• Складові частини системи (компоненти)
Компонент – це індивідуальна хімічна речовина, що міститься в системі, може бути виділена з неї і може існувати окремо.
Наприклад, компонентами водного розчину натрій хлориду є вода і натрій хлорид.Іони натрію і хлору не можуть вважатися компонентами, так як вони не існують як окремі речовини.
Будь-які системи складаються з певної кількості індивідуальних речовин - складових частин системи. Наприклад, водний розчин сульфату натрію і сульфату калію складається з трьох складових частин: води, сульфату натрію, сульфату калію. Кожна з них є індивідуальною речовиною, яка може існувати самостійно, незалежно від інших складових частин.
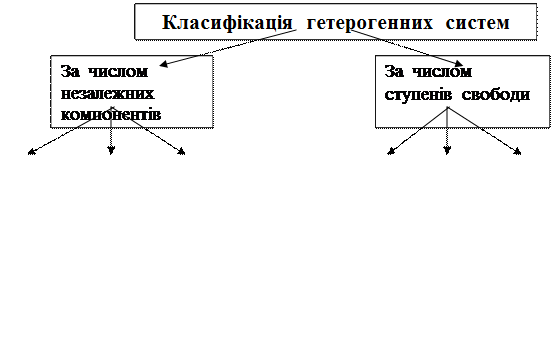
• Число незалежних компонентів (К) -найменше число складових частин системи, концентрації яких треба знати, щоб описати властивості системи в цілому.
Запам'ятайте! Число незалежних компонентів дорівнює числу складових частин мінус число можливих реакцій між ними.
Наприклад, однорідна суміш трьох компонентів азоту (N2), водню (H2), аміаку (NНз) має два незалежних компоненти, оскільки в цій системі між компонентами може відбуватися одна реакція:
N2 + 3H2 = 2NНз
Гетерогенні системи - це системи багатофазні. Вони складаються з двох або більше фаз.
Фаза - однорідна (гомогенна) частина гетерогенної системи, яка має однаковий склад, фізичні та хімічні властивості та відокремлена від інших частин фазовою поверхнею.
Наприклад, суміш вода - олія є гетерогенною двофазною системою. Система рідка вода - лід - пара є гетерогенною трьохфазною системою.
Між фазами гетерогенної системи може встановлюватися рівновага.
Фазова рівновага – рівновага між фазами гетерогенної системи.
Прикладом фазової рівноваги є стан системи «вода-насичений пар». При сталій температурі тиск насиченого пару над рідиною буде сталим, так
як при рівновазі швидкість випаровування дорівнює швидкості конденсації. В насиченому розчині солі в рівновазі знаходяться рідкий розчин солі і кристали. В такій системі швидкість розчинення дорівнює швидкості кристалізації.
Число ступенів свободи – це число умов (температура, тиск, концентрація), які можна змінювати довільно (в певних межах), не змінюючи числа і виду фаз системи.
Між числом фаз (Ф), числом незалежних компонентів (К), числом ступенів свободи (С) є зв'язок, який був виявлений у 1876 р. Гіббсом, і отримав назву – правило фаз Гіббса:
Число ступенів свободи системи при рівновазі дорівнює числу незалежних компонентів, мінус число фаз, плюс число факторів, які впливають на рівновагу (температура, тиск)
С = К - Ф + n,
де n - число факторів, що впливають на рівновагу (температура, тиск)
Для газів: С = К - Ф + 2,
Для рідин: С = К - Ф + 1.
       |
!ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Задача 8.
Розрахуйте рівноважні концентрації водню і йоду при температурі 600 К в реакції:
Н2 + І2 = 2НІ,
якщо їх початкові концентрації складають 0,03  , а рівноважна концентрація НІ дорівнює 0,04
, а рівноважна концентрація НІ дорівнює 0,04  . Знайти константу рівноваги та величину ізобарно – ізометричного потенціалу реакції при цій температурі.
. Знайти константу рівноваги та величину ізобарно – ізометричного потенціалу реакції при цій температурі.
Розв’язання:
На утворення 2 молей НІ у відповідності з рівнянням реакції іде
1 моль Н2 і 1 моль І2, тому для утворення 0,04 моля необхідно:
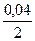 =0,02 моля Н2 і 0,02 моля
=0,02 моля Н2 і 0,02 моля
І, звідси їх рівноважні концентрації складають:
0,03 – 0,02 = 0,01 (моля).
Для розрахунку константи рівноваги після написання виразу в загальному вигляді К = 
Підставимоу цей вираз числові дані:
К= 
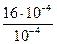 =16
=16
Далі розрахуємо зміну ізобарно – ізотермічного потенціалу цього процесу, використовуючи зв’язок величин ∆ Є і К
∆G = -RTℓnК = -2,303 RT ℓq К
∆ G =-2,303 · 8,313 ·600 · ℓq16 = - 2,303 · 8,313 х 600 · 1,204 = -132830 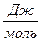 =
=
= -13,83 
Задача 9
Знайти константу рівноваги при температурі 250С реакції:
С2Н2 (газ) + 2Н2 г(газ) = С2Н6 (газ),
якщо ∆Н0 = 324,2  і ∆S0 =10,22
і ∆S0 =10,22 
Розв’язання.
Зв’язок між константою рівноваги в стандартних умовах з стандартним ізобарно-ізотермічним потенціалом реакції виражається рівнянням
∆ G 0 = -RTℓnК = -2,303 RT ℓqК
∆ G 0 = -2,3 · 8,3 ·293 · ℓqК (1)
Стандартний ізобарний потенціал зв’язаний з стандартними значеннями ентальпії і ентропії реакції співвідношення:
Знайдемо величину ізобарно - ізотермічного потенціалу за рівнянням (2) з даних задачі, перевівши в Джоулі.
 |
∆ G 0 = -324200 – 298(-10,22) = -327245 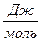 =327,245
=327,245 
Тепер, користуючись знайденим значенням і рівнянням (1), розрахуємо
ℓqК = 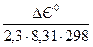 =
= 
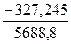 = +0,0575
= +0,0575
Користуючись таблицею антилогарифмів, знайдемо значення К: К = 1,139
САМОСТІЙНА РОБОТА
@Задача 10.
Знайдіть константу рівноваги реакцій при стандартній температурі (298К) за даними таблиці:
| № варі-анту | Реакція | ∆Н0298 реакції

| ∆Н0298 реакції

|
  N2 + 3H2 2 NH3 N2 + 3H2 2 NH3
| -92,45 | -198,45 | |
  2 NO N2O4 2 NO N2O4
| 58,07 | ||
  H2CO3 H + HCO3-
розчин розчин розчин H2CO3 H + HCO3-
розчин розчин розчин
| 7,46 | -99,47 | |
  2Н2 + О2 2Н2О(г) 2Н2 + О2 2Н2О(г)
| 483,04 | -88,76 | |
| S + O2 (г) = SО2 | -292,9 | 25,15 |
@Задача 11
Складіть вираз для константи рівноваги і розрахуйте її значення. Рівноважні концентрації реагуючих речовин (С, моль/л) наведені під відповідними хімічними формулами в рівнянні реакції.
| № варіанту | С,

| Реакції |
| С |   N2 + 3H2 2 NH3
3 9 4 N2 + 3H2 2 NH3
3 9 4
| |
| С |   H2 + I2 2HI
0,01 0,01 0,04 H2 + I2 2HI
0,01 0,01 0,04
| |
| С |   СО2 + Н2 СО + Н2О
0,04 0,64 0,16 0,16 СО2 + Н2 СО + Н2О
0,04 0,64 0,16 0,16
| |
| С |   2SO2 + O2 2SO3
0,1 0,05 0,9 2SO2 + O2 2SO3
0,1 0,05 0,9
| |
| С |   2 NO2 2NO + O2
0,06 0,24 0,12 2 NO2 2NO + O2
0,06 0,24 0,12
|
РОЗЧИН НЕЕЛЕКТРОЛІТІВ
Задача 12
Розрахуйте осмотичний тиск розчину гліцерину, що містить 0,46г гліцерину в 100 мл розчину при 20о С.
Розв’язання.
За законом Вант-Гоффа: Росм = СRТ,
де С - концентрація речовини в молях на літр розчину (молярна);
R- універсальна газова стала; R = 8,31 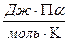
Т – абсолютна температура;
Росм. - осмотичний тиск розчину;
Молярна концентрація С визначається із співвідношенням: 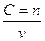 =
= 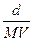
де n -число малів розчиненої речовини в даному об’ємі розчину;
d - вага розчиненої речовини, г; V –об’єм розчину л; М – молекулярна маса розчиненої речовини. Тоді: Росм. = 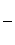
Росм = 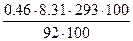 = 121,7 Пα = 1,2 атм.
= 121,7 Пα = 1,2 атм.
Задача 13
Розчин, що містить 0,48 гліцерину на 25г Н2О, замерзає при температурі - 0,387 0С. Розрахувати молекулярну масу гліцерину та осмотичний тиск розчину при О0С
Розв’язання.
1. Визначення молекулярної ваги гліцерину
Δt = К · m, де К – кріоскопічна стала;
для водних розчинів К = 1,860С,
m – моляльна концентрація 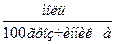
m =  ,
,
де Р – вага розчиненої речовини в г;
W (α) – вага розчинника в г;
М - молярна маса речовини;
∆ t = 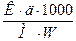 => М =
=> М = 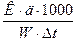
∆ t = 00 – (-0,3870)= 0,3870
М= 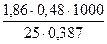 = 92
= 92
2. Визначення осмотичного тиску.
Осмотичний тиск розчину розраховується за допомогою рівняння:
Росм = СRТ і ∆t = К •m
Для розбавлення водних розчинів
С = m = 
Росм. =  Rt
Rt
Росм = 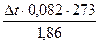 = 12,04 ∆t;
= 12,04 ∆t;
Росм = 12,04 • 0,387 = 4,67 (атм.)
САМОСТІЙНА РОБОТА
@Задача 14.
Для наведених нижче розчинів розрахуйте осмотичний тиск при 20℃ та молекулярну масу розчиненої речовини (середню для біологічних об’єктів), користуючись даними таблиці.
| № вар. | Розчин | Концентрація (%) | ∆t замер- зання | Кріоско- пічна стала | Моляр- на маса |
| Вода / моносахарид | 3,6 | 0,385 | 1,86 | ? | |
| Вода / мочевина | 7,24 | 2,42 | 1,86 | ? | |
| Вода / дисахарид | 68,4 | 6,51 | 1,86 | ? | |
| Вода / спирт | 0,79 | 0,354 | 1,86 | ? | |
| Вода / полівініловий спирт | 5,33 на 257г Н2О | 0,113 | 1,86 | ? | |
| Клітковий сік | Ізотонічний з 4% розчином глюкози | 0,62 | 1,86 | ? | |
| Клітковий сік | Ізотонічний з 4% розчином глюкози | 0,76 | 1,86 | ||
| Сірка S8 / бензол | 18г сірки 250гС6Н6 | 0.514 | ? | 32,8 ат.од. маси | |
| Кров | Ізотонічна з 0,34М розчином неелектроліту | 0,54 | 1,86 | ? | |
| Ацетон / оцтова кислота | 0,50г ацетону + 100г кислоти | 0,339 | ? | 58 ат.од. маси |
& ТИМ, ХТО ХОЧЕ ЗНАТИ БІЛЬШЕ
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 13398; Нарушение авторских прав?; Мы поможем в написании вашей работы!