
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксигену й Сульфуру
|
|
|
|
ОКСИГЕН ТА СУЛЬФУР
Порівняльна характеристика будови атомів
| Протонне число | Хімічний символ | Будова атома | Будова електронних оболонок | Прості речовини | Властивості простих речовин |
| +8 | О | +⑧)) 2 6 |
       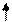            2S2 2P4
1S2
1S22S22P4 2S2 2P4
1S2
1S22S22P4
| О2 – кисень О3 - озон | газ, малорозчинний у воді, без запаху і кольору газ, нестійкий, без кольору, з запахом свіжості |
| +16 | S | +⑯))) | 3 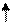   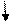 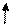 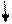        S2 3P4 3d0 S2 3P4 3d0
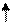   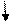 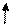               2S2 2P6
1S2
1S22S22P6
3S23P4 2S2 2P6
1S2
1S22S22P6
3S23P4
| S8 – кристалічна S - пластична | Жовтий порошок, не змочується водою, неелектро− провідний коричнева пластична маса |
Алотропні форми кисню
| Ознаки для порівняння | кисень О2 | озон О3 |
| Фізичні властивості | Газ без запаху, безбарвний, у товстих шарах блакитнуватий | Газ із гострим характерним запахом, має блакитнуватий колір навіть у невеликих кількостях |
| Фізіологічна дія | Забезпечує життєдіяльність організмів | У невеликих кількостях корисний, оскільки вбиває хвороботворні організми, у великих – має отруйну дію |
| Хімічні властивості | Активний: сполучається майже зі всіма елементами (виняток – інертні гази) | Сильний окисник. Його активність пояснюється тим, що його молекула легко розщеплюється: О3 → О2 + О |
| Застосування | Для дезінфекції під час оброблення води | У металургії, медицині тощо |
Алотропні форми сірки
| ромбічна | моноклінна | пластична |
| Найбільш стійка за звичайних умов | Утворюється внаслідок нагрівання ромбічної сірки до температури, вищої за 96оС. у разі охолодження знову повертається до ромбічної форми | Киплячу сірку (444,6оС) виливають у холодну воду, утворюється пластична сірка, яка легко розтягується на зразок гуми |
Поширення сірки в природі
|
|
|
| У водах мінеральних джерел, морів, океанів | У нафті та кам’яному вугіллі | Входить до складу білкових молекул живих організмів | У складі природних сполук |
Хімічні властивості сірки
| Властивість | Рівняння реакції | Тип реакції |
| 1.Взаємодія з неметалами: а)гідрогеном, б)оксигеном. | Сірка – окисник S + Н2 → Н2S гідроген сульфід (сірководень) Сірка – відновник S + О2 → SО2 + Q сульфур (ІV) оксид 2S +3 О2 → 2SО3 сульфур (VІ) оксид | сполучення сполучення |
| 2.Взаємодія з металами. | Сірка – окисник
3S +2 Al → Al2S3
алюміній сульфід
S + 2Na → Na2S
натрій сульфід
3S0 +2 Al0 → Al2+3S3−2
 S0 + 2ē → S−2 3 окисник
Al0 - 3ē → Al+3 2 відновник S0 + 2ē → S−2 3 окисник
Al0 - 3ē → Al+3 2 відновник
| сполучення термохімічне окисно-відновне |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 3978; Нарушение авторских прав?; Мы поможем в написании вашей работы!