
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрование слабой кислоты сильным основанием
|
|
|
|
Пример 21 поможет Вам при решении задач № 143, 147, 148.
Пример 21. Построить кривую титрования муравьиной кислоты (С0 = 0,20 моль/л) раствором КОН c концентрацией 0,40 моль/л и подобрать индикаторы.
Решение. Муравьиная кислота – слабая кислота, а КОН – сильное основание, поэтому в данном случае рассмотрим титрование слабой кислоты сильным основанием. Расчет проводим без учета изменения объема раствора.
Предположим, что для титрования взяли 100,00 мл (V0) раствора НСООH (С0 = 0,20 моль/л). Рассчитаем объем раствора КОН (V х), необходимый для полного оттитровывания HCOOH.
100,00 · 0,20 = V х · 0,40; V х = 50,00 мл.
1. рН исходного раствора рассчитываем по формуле для расчета рН раствора слабой кислоты (2):
рН = 1/2 рКа – 1/2 lg С0 = 1/2 3,75 – 1/2 lg 0,20 = 2,57.
2. В любой момент титрования до точки эквивалентности в растворе существует буферная смесь, состоящая из неоттитрованной муравьиной кислоты и образовавшегося формиата калия. Расчет рН в этой области проводим по уравнению (7). При этом, аналогично предыдущему примеру, концентрацию кислоты и соли можно рассчитать следующим образом:
Ск = (Со ∙ Vo – Ст ∙ Vт)/ Vo; Сc = Ст ∙ Vт/ Vo.
Отсюда отношение концентраций можно рассчитать как
Ск/Сc = [(Со ∙ Vo – Ст ∙ Vт)/ Vo] / (Ст ∙ Vт/ Vo) =
= (Со ∙ Vo – Ст ∙ Vт) / Ст ∙ Vт/ Vo.
Следовательно, формула для расчета рН имеет вид
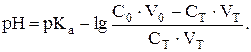
При добавлении 25,00 мл (50 %) раствора гидроксида калия:
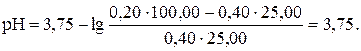
Таким же образом рассчитываем рН при прибавлении 45,00 мл раствора КОH (45,00: 50,00 · 100 = 90 %):

Если добавлено 49,50 мл раствора КОH (49,50: 50,00 · 100 = = 99 %):
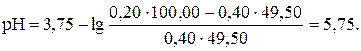
При добавлении 49,95 мл раствора титранта (99,9 %), что соответствует точке начала скачка титрования:
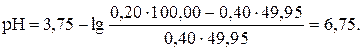
3. В точке эквивалентности вся муравьиная кислота прореагировала и превратилась в соль, концентрация которой Ссоли = Скислоты = = 0,2 моль/л. рН раствора соли слабой кислоты рассчитывали по формуле (5):
|
|
|

4. За точкой эквивалентности величина рН раствора определяется только избытком добавленного титранта. Расчет рН проводится аналогично примеру 20. Например, при добавлении 50,05 мл раствора КОН (100,1%):
рН = 14 + lg [(50,05 – 50,00) · 0,40/100,00] = 10,30.
При добавлении 50,50 мл раствора КОН (101%)
рН = 14 + lg [(50,50 – 50,00) · 0,40/100,00] = 11,30.
При добавлении 55,00 мл раствора КОН (110%)
рН = 14 + lg [(55,00 – 50,00) · 0,40/100,00] = 12,30.
Результаты сведем в табл. 2, по данным которой построим кривую титрования (рис. 2).
Таблица 2
| Объем титранта VT, мл | рН-определяющий компонент | Формула для расчета рН | рН |
| НСООН | рН = 1/2 рКа – 1/2 lg С0 | 2,57 | |
| 25,00 | НСООН и НСООК | 
| 3,75 |
| 45,00 | НСООН и НСООК | -″- | 4,70 |
| 49,50 | НСООН и НСООК | -″- | 5,75 |
| 49,95 | НСООН и НСООК | -″- | 6,75 |
| 50,00 | НСООK | рН = 7+1/2 рКа +1/2 lg Сc | 8,53 |
| 50,05 | KOH | pH = 14+lg СT | 10,30 |
| 50,50 | KOH | -″- | 11,30 |
| 55,00 | КОН | -″- | 12,30 |
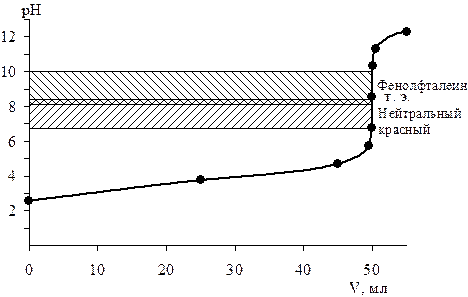
Рис. 2. Кривая титрования 0,20 моль/л раствора муравьиной кислоты 0,40 моль/л раствором гидроксида калия
По справочнику [3] выбираем подходящие индикаторы: нейтральный красный (интервал перехода 6,8–8,4; рТ=8,0), феноловый красный (интервал перехода 6,8–8,4; рТ=8,0), тимоловый синий (интервал перехода 8,0–9,6; рТ=9,0), фенолфталеин (интервал перехода 8,2–10,0; рТ=9,0), поскольку интервалы перехода этих индикаторов лежат в пределах скачка кривой титрования.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 7539; Нарушение авторских прав?; Мы поможем в написании вашей работы!