
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация растворов
|
|
|
|
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
· Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:

|
· где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
· Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:

|
· где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами*).
· *) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
· Мольная доля растворенного вещества χ(B) выражается соотношением
 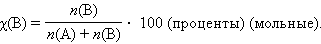
|
· Сумма мольных долей k компонентов раствора χi равна единице 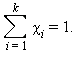
К размерным концентрациям относятся следующие концентрации:
· Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.

|
· Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:

|
· где μ(B) – молярная масса B, V – объем раствора.
· Молярная концентрация эквивалентов вещества B C Э(B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
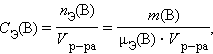
|
· где nЭ(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
|
|
|
· Титр раствора вещества B(T B) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
 г∙мл–1 или г∙мл–1 или
|
·
 г∙мл–1. г∙мл–1.
|
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (вода-бензол, вода-бутиловый спирт, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-BaSO4, вода-бензин).
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 497; Нарушение авторских прав?; Мы поможем в написании вашей работы!