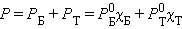КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы неэлектролитов
|
|
|
|
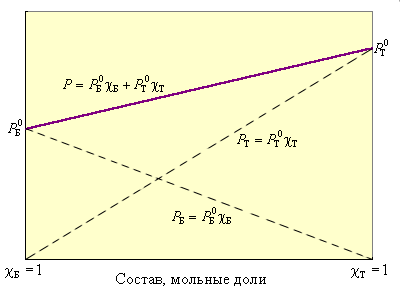
По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь. Следовательно, любое свойство растворяемых веществ при их смешении не должно меняться. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Рауля будет аддитивной величиной
|
Здесь 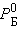 и
и 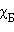 ,
, 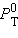 и
и 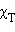 – соответственно давление и мольные доли бензола и толуола.
– соответственно давление и мольные доли бензола и толуола.
|
| Рисунок 6.1. Зависимость давления пара над смесью бензол–толуол от мольной доли. |
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ→0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольвации ΔHсольв, служит в определенных пределах мерой идеальности раствора. Д. И. Менделеев показал, что взаимодействие между компонентами раствора может рассматриваться как химический процесс образования соединений переменного состава – сольватов. Этот подход лежит в основе химической или сольватной теории растворов. Если при кристаллизации твердая фаза содержит молекулы растворителя, то ее называют кристаллосольватом.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 337; Нарушение авторских прав?; Мы поможем в написании вашей работы!