
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферная емкость
|
|
|
|
Границы буферного действия
Буферное действие
Механизм буферного действия заключается в том, что частицы сопряженного основания реагируют с ионом H3O+, образуя сопряженную слабую кислоту.
В общем виде: H3O+ + A- = H2O + HA
Например, в случае аммиачной буферной системы имеем: H3O++ NH3 = NH4+ + H2O
Ионы же OH- взаимодействуют с сопряженной кислотой, превращая ее в сопряженное слабое основание.
В общем случае: HA + OH- = H2O + A-
В случае той же аммиачной буферной системы: NH4+ + OH- = NH3 + H2O
Границы буферного действия определяются, исходя из значения рК данной буферной системы и отличаются от него в обе стороны не более чем на единицу.
pH = pK ± 1
Буферная емкость является количественной характеристикой буферного раствора. Определяются буферная емкость по кислоте (Вк) и буферная емкость по щелочи (Вщ).
Буферная емкость определяется как количество вещества H3O + (или OH-) которое надо добавить к 1л данной буферной системы, чтобы его рН изменился на 1. Напомнить студентам, что при добавлении сильной кислоты к буферной системе рН немного уменьшается, а при добавлении щелочи немного увеличивается.
n(H3O+)добавл. n(ОH-)добавл.
Bк = ------------------- Вщ = -------------------
Vбуф.р-ра . |ΔpH| Vбуф.р-ра . |ΔpH|
Пример1. Рассмотреть буферные равновесия в буферной системе NH3- NH4Cl
Решение. Соль диссоциирует на ионы практически полностью:
NH4Cl = NH4+ + Cl -
Ион аммония является слабой катионной кислотой:
NH4 + + Н2О ↔ NH3 + Н3О+ (1)
Аммиак – нейтральное слабое основание, его протолиз записывается так:
NH3 + Н2О ↔ NH4 + + ОН - (2)
Уравнения (1) и (2) представляют собой уравнения буферных равновесий. По принципу Ле Шателье равновесие в обоих процессах сильно смещено влево. По этой причине равновесные концентрации аммиака и иона аммония практически равны их начальным концентрациям.
|
|
|
Расчет рН в буферных системах производится с помощью уравнения Гендерсона- Хассельбальха.
a (сопр.осн-я)
pH = pKa + lg-----------------
а (сопр. к-ты)
Аммиак – нейтральная молекула и для него коэффициент активности равен 1. Тогда для данной системы уравнение приобретает вид:
с0(NH3)
pH = pKa + lg-----------------
c0(NH4+). f(NH4+)
Пример 2. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 - /HPO42-)= 7,2.
Решение:
рН буферного раствора равно: рН = рКа + lg 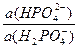
Определяем ионную силу раствора.
KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42-
0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
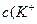 )=
)= 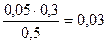 моль/л c(Na
моль/л c(Na 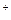 )=
)= 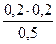 = 0,08моль/л
= 0,08моль/л
c(H2PO4-)= 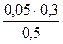 = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)= 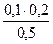 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По таблице находим коэффициенты активности f ионов. 

f( H2PO4-) =0,81. f (HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 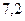 +lg
+lg 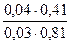 = 7,03.
= 7,03.
Пример 3. Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76.
Ионную силу раствора точно определить заранее нельзя, так как неизвестно количество и концентрация сильного электролита в полученном растворе. Однако можно создать требуемую ионную силу введением инертного электролита типа NaCl, Na2SO4. Для определенности примем ионную силу равную I = 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1. Коэффициент активности иона аммония при данном значении ионной силы равен 0,81.
pН данной буферной системы равно: рН = рКа(NH4+) + lg 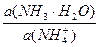
pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 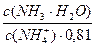
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 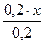 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)= 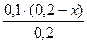 =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
|
|
|
9,54 = 9,24 + lg 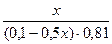 lg
lg 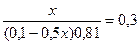
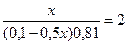 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 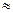 90мл.
90мл.
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Пример 4. а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
Решение:
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 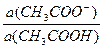
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 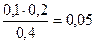 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу по концентрации сильного электролита:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем ввиду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН = 4,76 + lg 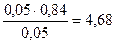
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
n(исх) 0,02 0,01 0,02 моль
n(прореаг.) 0,01 0,01 0,01 моль
n(оставш.) 0.01 0 0,03 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 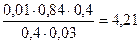
Буферная ёмкость по кислоте равна:
Bк = 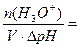
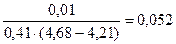 моль/(л. ед рН)
моль/(л. ед рН)
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH + OH- = CH3COO- + H2O
0,02 0,01 0,02 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое (буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало: 0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 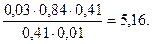
|
|
|
Буферная ёмкость по щёлочи равна: Вщ = 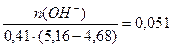 моль/(л . ед.рН)
моль/(л . ед.рН)
Пример 1. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 -)= 7,2.
Решение:
рН буферного раствора равно: рН = рКа + lg 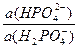
Определяем ионную силу раствора.
KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42-
0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
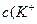 )=
)= 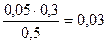 моль/л c(Na
моль/л c(Na 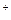 )=
)= 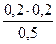 = 0,08моль/л
= 0,08моль/л
c(H2PO4-)= 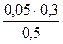 = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)= 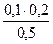 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По таблице находим коэффициенты активности f ионов. 

f(H2PO4-) =0,81. f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 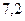 +lg
+lg 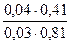 = 7,03.
= 7,03.
Пример 2 Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1,
а f(NH4+) = 0,81 в соответствии с ионной силой.
pН данной буферной системы равно: рН = рКа(NH4+) + lg 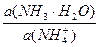
pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 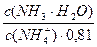
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 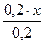 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)= 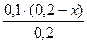 =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54 = 9,24 + lg 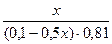 lg
lg 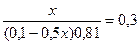
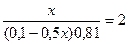 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 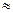 90мл.
90мл.
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Пример 3 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
Решение:
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 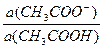
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 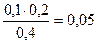 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
|
|
|
Рассчитываем рН буферной системы:
pН = 4,76 + lg 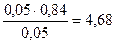
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
0,02 0,01 0,01 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 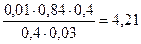
Буферная ёмкость по кислоте равна: Bк = 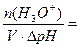
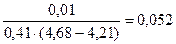 моль/л.
моль/л.
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH + OH- = CH3COO- + H2O
0,02 0,01 0,01 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало:
0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 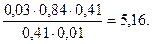
Буферная ёмкость по щёлочи равна: Вщ = 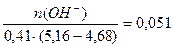 моль/л.
моль/л.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 2058; Нарушение авторских прав?; Мы поможем в написании вашей работы!