
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Массовый, объемный и мольный состав
|
|
|
|
Смесь, состоящая из двух и более компонентов, характеризуется свойствами и содержанием этих компонентов. Состав смеси может быть задан массой, объемом, количеством (числом молей или килограмм-молей) отдельных компонентов, а также значениями их концентраций. Концентрацию компонента в смеси можно выразить в весовых, мольных и объемных долях или процентах, а также в других единицах.
Массовая доля wi какого-либо компонента определяется отношением массы mi данного компонента к массе всей смеси mсм:
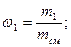
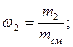
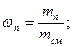
Учитывая, что суммарная масса смеси равна сумме масс отдельных компонентов, т.е.
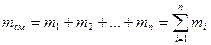
можно написать:
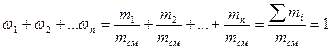
или сокращенно:
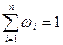
Пример 4. Смесь состоит из двух компонентов: m1 = 500 кг, m2 = 1500 кг. Определить массовую долю каждого компонента в смеси.
Решение. Массовая доля первого компонента:
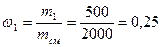
mсм= m1 + m2 = 500 + 1500 = 2000 кг
Массовая доля второго компонента:
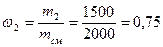
Массовую долю второго компонента можно определить также, используя равенство:
w1 + w2 = 1
w2 = 1 – w1 = 1 – 0,25 = 0,75
Объемная доля ni компонента в смеси равна отношению объема Vi данного компонента к объему всей смеси V:
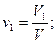
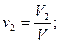
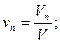
Учитывая, что:
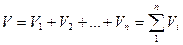
можно написать:
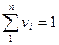
Пример 5. Газ состоит из двух компонентов: V1 = 15,2 м3 метана и V2 = 9,8 м3 этана. Подсчитать объемный состав смеси.
Решение. Общий объем смеси равен:
V = V1 + V2 = 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана 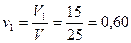
этана v 2 = 1 – v 1 = 1 – 0,60 = 0,40
Мольная доля ni какого-либо компонента смеси определяется как отношение числа киломолей Ni данного компонента к общему числу киломолей N смеси:
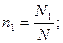
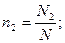
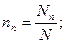
Учитывая, что: 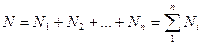
получим: 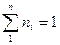
Пересчет мольных долей в массовые можно проводить по формуле:
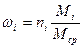
Пример 6. Смесь состоит из 500 кг бензола и 250 кг толуола. Определить мольный состав смеси.
Решение. Молекулярный вес бензола (С6Н6) равен 78, толуола (С7Н8) – 92. Число килограмм-молей равно:
бензола 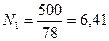
толуола 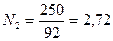
общее число килограмм-молей:
N = N1 + N2 = 6,41 + 2,72 = 9,13
Мольная доля бензола равна:
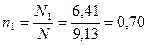
Для толуола мольная доля может быть найдена из равенства:
n1 + n2 = 1
откуда: n2 = 1 – n1 = 1 – 0,70 = 0,30
Среднюю молекулярную массу смеси можно определить, зная мольную долю и молекулярную массу каждого компонента смеси:
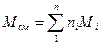 (21)
(21)
где n i — содержание компонентов в смеси, мол. доли; Mi — молекулярная масса компонента смеси.
Молекулярную массу смеси нескольких нефтяных фракций можно определить по формуле
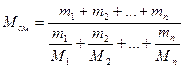 (22)
(22)
или
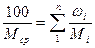 (23)
(23)
где m1, m2,…, mn — масса компонентов смеси, кг; M1, М2,....,.Мп - молекулярная масса компонентов смеси; 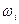 - % масс. компонента.
- % масс. компонента.
Молекулярную массу нефтепродукта можно определить также по формуле Крэга
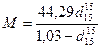 (24)
(24)
Пример 7. Определить среднюю молекулярную массу смеси бензола с изооктаном, если мольная доля бензола составляет 0,51, изооктана 0,49.
Решение. Молекулярная масса бензола 78, изооктана 114. Подставляя эти значения в формулу (21), получаем
Мср = 0,51 × 78 + 0,48×114 = 95,7
Пример 8. Смесь состоит из 1500кг бензола и 2500кг н -октана. Определить среднюю молекулярную массу смеси.
Решение. Используем формулу (22)
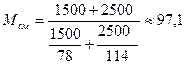
Объемный молярный состав пересчитывают в массовый следующим образом. Данный объемный (молярный) состав в процентах принимают за 100 молей. Тогда концентрация каждого компонента в процентах будет выражать число его молей. Затем число молей каждого компонента умножают на его молекулярную массу и получают массу каждого компонента в смеси. Разделив массу каждого компонента на общую массу, получают его массовую концентрацию.
Массовый состав пересчитывают в объемный (молярный) следующим образом. Принимают, что смеси взято 100 (г, кг, т) (если массовый состав выражен в процентах), массу каждого компонента делят на его молекулярную массу. Получают число молей. Делением числа молей каждого компонента на их общее число получают объемные (молярные) концентрации каждого компонента.
Средняя плотность газа определяется по формуле:
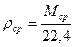 кг/м3; г/см3
кг/м3; г/см3
или, исходя из объемного состава:
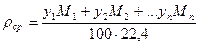 ,
,
или, исходя из массового состава смеси:
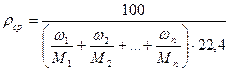 .
.
Относительную плотность определяют по формуле:
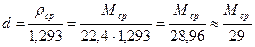
Пример 9. Пересчитать массовый состав газа в объемный и определить его молекулярную массу, его плотность и относительную плотность.
| Компоненты | М г/моль | массовый состав, % масс. | mi | Число молей
 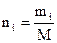
| Объемный состав | |
| доли единицы | % об. | |||||
| Метан | 40:16=2,50 | 0,669 | 66,9 | |||
| Этан | 10:30=0,33 | 0,088 | 8,8 | |||
| Пропан | 15:44=0,34 | 0,091 | 9,1 | |||
| Бутан | 25:58=0,43 | 0,115 | 11,5 | |||
| Пентан + высшие | 10:72=0,14 | 0,037 | 3,7 | |||
| 3,74 | 1,000 | 100,0 |
Для простоты расчета примем массу смеси за 100 г, тогда масса каждого компонента будет численно совпадать с процентным составом. Найдем число молей ni каждого компонента. Для этого массу каждого компонента mi разделим на мольную массу:
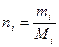
Находим объемный состав смеси в долях единицы
wi(CH4) = 2,50: 3,74 = 0,669;  w(C2H6) = 0,33: 3,74 = 0,088;
w(C2H6) = 0,33: 3,74 = 0,088; 
 w(C5H8) = 0,34: 3,74 = 0,091;
w(C5H8) = 0,34: 3,74 = 0,091;  w(C4H10) = 0,43: 3,74 = 0,115;
w(C4H10) = 0,43: 3,74 = 0,115; 
 w(C5H12) = 0,14: 3,74 = 0,037.
w(C5H12) = 0,14: 3,74 = 0,037.
Находим объемный состав смеси в процентах, умножив данные в долях единицы на 100%. Все полученные данные заносим в таблицу.
Рассчитываем среднюю массу смеси.

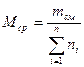
Мср = 100: 3,74 = 26,8 г/моль
Находим плотность смеси 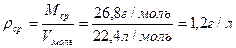
Находим относительную плотность:
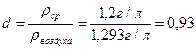
Пример 10. Пересчитать объемный состав в массовый и определить его молекулярную массу, его плотность и относительную плотность.
| Компоненты | М г/моль | Объемный состав, % об. | число молей ni | Масса компонента г. | Весовой состав | |
| доли единицы | % масс. | |||||
| Метан | 30×16=480 | 0,117 | 11,7 | |||
| Этан | 15·30=450 | 0,109 | 10,9 | |||
| Пропан | 20·44=880 | 0,214 | 21,4 | |||
| Бутан | 15·58=870 | 0,211 | 21,1 | |||
| Пентан + высшие | 20·72=1440 | 0,349 | 34,9 | |||
| 1,000 | 100,0 |
 w(CH4) = 480: 4120 = 0,117;
w(CH4) = 480: 4120 = 0,117;  w(C2H6) = 450: 4120 = 0,109;
w(C2H6) = 450: 4120 = 0,109;

 w(C3H8) = 880: 4120 = 0,214;
w(C3H8) = 880: 4120 = 0,214;  w(C4H10) = 870: 4120 = 0,211;
w(C4H10) = 870: 4120 = 0,211;

 w(C5H12) = 1440: 4120 = 0,349.
w(C5H12) = 1440: 4120 = 0,349.
Мср = 4120: 100 = 41,2 г/моль.
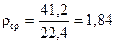 г/л
г/л
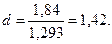

Задача 15. Смесь состоит из пяти компонентов. Определить массовую, объемную и мольную долю каждого компонента в смеси, среднюю молекулярную массу смеси.
| Компоненты смеси | Вариант | |||||||||
| mi (г) | mi (кг) | mi (т) | ||||||||
| метан | ||||||||||
| этан | ||||||||||
| пропан | ||||||||||
| н -бутан | ||||||||||
| изобутан |
Задача 16. Пересчитать массовый состав газа в объемный и определить его молекулярную массу, плотность и относительную плотность по воздуху.
| Компоненты смеси | ω% массовый состав газа | |||||||||
| Варианты | ||||||||||
| метан | ||||||||||
| этан | ||||||||||
| пропан | ||||||||||
| бутан | ||||||||||
| пентан |
Задача 17. Пересчитать объемный состав газа в массовый и определить его молекулярную массу, плотность и относительную плотность по воздуху.
| Компоненты смеси | объемный состав газа ω% объем | |||||||||
| Варианты | ||||||||||
| метан | ||||||||||
| этан | ||||||||||
| пропан | ||||||||||
| бутан | ||||||||||
| пентан |
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 39595; Нарушение авторских прав?; Мы поможем в написании вашей работы!