
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Десять вислідів з попередньої частини лекції
|
|
|
|
1. Величини F i G утворені за допомогою термодинамічних функцій і параметрів U, H, S, Т і тому теж є функціями термодинамічного стану, за величинами яких або їх похідних можна визначити термодинамічний стан у явній формі і розрахувати будь-які інші термодинамічні величини.
2. Функції S, U, H, F, G набувають ознак характеристичних функцій, якщо S=S(U,V), U=U(V,S); H=H(p,S); F=F(V,T); G=G(p,T), при цьому U, H, F, G є термодинамічними потенціалами.
3. Співвідношення між U, H, F, G, ТS, pV показано на рис. 7.4, який побудований за:
H=U+pV; U=F+TS; H=G+TS.
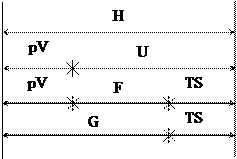 |
Рис. 7.4. Співвідношення між термодинамічними параметрами
і характеристичними функціями
4. Функції U, H, S, F, G характеризують умови термодинамічної рівноваги системи при різних умовах взаємодії термодинамічної системи із зовнішнім середовищем.
5. В ізольованих системах Q=0; U,V=const довільно (самочинно, спонтанно) можуть протікати лише ті процеси, які супроводжуються зростанням ентропії dS≥0, при цьому границею їх протікання (необхідною, але недостатньою умовою їх рівноваги) є досягнення деякого максимального для даних умов значення ентропії: S= Smax, dS=0, d2S<0.
6. У системах, що знаходяться при V,Т=const, довільно (самочинно, спонтанно) можуть протікати лише ті процеси, які супроводжуються зменшенням ізохорно-ізотермного потенціалу F≤0, при цьому границею їх протікання (необхідною, але недостатньою умовою їх рівноваги) є досягнення деякого мінімального для даних умов значення цього потенціалу: F=Fmin, dF=0, d2F>0.
7. У системах, що знаходяться при р,Т=const, довільно (самочинно, спонтанно) можуть протікати лише ті процеси, які супроводжуються зменшенням ізобарно-ізотермного потенціалу G≤0, при цьому границею їх протікання (необхідною, але недостатньою умовою їх рівноваги) є досягнення деякого мінімального для даних умов значення цього потенціалу: G =G min, dG =0, d2G >0.
|
|
|
8. Все це (п. 5, 6, 7) не означає, що процеси, які супроводжуються зменшенням ентропії dS<0, не можуть відбуватися при U,V=const, або процеси, які супроводжуються зростанням ізохорно-ізотермного потенціалу dF>0, не можуть відбуватися при V,Т=const, або процеси, які супроводжуються зростанням ізобарно-ізотермного потенціалу dG >0, не можуть відбуватися при р,Т=const, але такі процеси несамочинні і можливі в системі при отриманні нею енергії ззовні, наприклад, роботи, або витрат електричної енергії (шляхом електролізу, або за допомогою електричного розряду), або під дією світла у фотохемічних реакціях тощо.
9. Це не заперечує можливість спонтанного (самочинного, довільного) протікання процесів і умов рівноваги в системах, які знаходяться при інших умовах (сталих параметрах), які визначаються зміною інших термодинамічних величин.
10. Критеріїв рівноваги не виявлено і не запропоновано. За такі приймаються критерії оборотности термодинамічних процесів. Вірно те, що рівновагові стани в хемічних і фізико-хемічних процесах, що визначає хемічна термодинаміка, дійсно існують. Але правдиво і те, що існують рівновагові стани, які хемічною термодинамікою передбачити неможливо. І справа тут полягає у тому, що рівновага необхідна, але недостатня умова термодинамічної оборотности процесів, тобто не у всіх рівновагових станах можливий оборотній процес.
Таким чином, критерії оборотности будуть співпадати з критеріями рівноваги тільки тих рівновагових станів, в яких можливі оборотні термодинамічні процеси.
Не маючи критеріїв рівноваги і користуючись критеріями оборотности термодинамічного процесу для визначення термодинамічного рівновагового стану, визначають лише частину рівновагових станів.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!