
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хемічна рівновага
|
|
|
|
9.2.1. Рівняння ізотерми хемічної реакції Якоба вант-Гоффа (vant Hoff) і константи рівноваги
1. При протіканні хемічної реакції

 aA+bB
aA+bB  l L+eE, (9.23)
l L+eE, (9.23)
де a, b, l, e – стехіометричні коефіцієнти,
через певний час наступає рівноваговий стан – хемічна рівновага. При цьому число молекул речовин, які складають хемічну систему, перестають змінюватися у часі, якщо зовнішні умови сталі.
2. Хемічна рівновага є динамічною, бо при зміні зовнішніх умов рівновага зміщується. Якщо при цьому зовнішні умови набувають вихідних значень, то й рівновага вертається до вихідного стану. Безкінечна мала зміна параметрів зовнішніх умов тягне за собою безкінечну малу зміну стану рівноваги.
Таким чином, хемічні реакції можуть протікати як термодинамічно рівновагові процеси, тобто до них можна прикласти загальні умови термодинамічної рівноваги.
3. Нехай реакція (9.23) протікає при p,T=const. У ході реакції число молей вихідних речовин A, B зменшується, а число молей продуктів реакції L, E зростає, тоді зміна ізобарно-ізотермного потенціалу Ґіббса:

 , (9.24)
, (9.24)
де 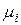 – хемічний потенціал і-го компоненту;
– хемічний потенціал і-го компоненту;
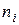 – кількість молей і-го компоненту.
– кількість молей і-го компоненту.
4. Речовини A, B, L, E реаґують пропорційно стехіометричним коефіцієнтам a,b,l,e рівняння (9.23). Замінимо dnA, dnB, dnL, dnE на  ,
,  ,
, 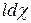 ,
,  , де χ – хемічна змінна.
, де χ – хемічна змінна.
Підставимо ці зміни в (9.24), отримаємо:
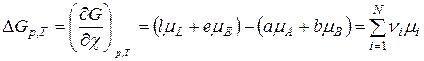 , (9.25)
, (9.25)
де 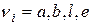 – стехіометричні коефіцієнти;
– стехіометричні коефіцієнти;
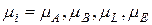 – хемічні потенціали;
– хемічні потенціали;
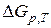 – ізобарний потенціал хемічної реакції (9.23), який дорівнює зміні потенціалу Ґіббса, коли речовини прореаґували відповідно до їх стехіометричних коефіцієнтів у рівнянні реакції (9.23) та χ=1.
– ізобарний потенціал хемічної реакції (9.23), який дорівнює зміні потенціалу Ґіббса, коли речовини прореаґували відповідно до їх стехіометричних коефіцієнтів у рівнянні реакції (9.23) та χ=1.
Величина 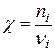 дорівнює співвідношенню кількости молей і-го компоненту речовини, що прореагувала, до його стехіометричного коефіцієнту, і в ході реакції зростає від 0 до 1.
дорівнює співвідношенню кількости молей і-го компоненту речовини, що прореагувала, до його стехіометричного коефіцієнту, і в ході реакції зростає від 0 до 1.
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 370; Нарушение авторских прав?; Мы поможем в написании вашей работы!