
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа
|
|
|
|
Уравнение состояния широко используется для определения свойств газа, расчета термодинамических процессов. Наиболее просто и точно эти расчеты могут быть выполнены для газов, состояние которых приближается к состоянию идеального газа.
Идеальным называется газ, состоящий из упругих молекул, между которыми отсутствуют силы взаимного притяжения и отталкивания, а объем, занимаемый молекулами бесконечно мал по сравнению с объемом пространства между ними. К такому состоянию реальные газы приближаются при увеличении их удельного объема, когда расстояния между отдельными молекулами велики. Следовательно, идеальный газ – это предельное состояние реального газа при υ → ∞ (или р → 0). Для идеальных газов термическое уравнение состояния идеального газа записывается в следующем виде:
р υ = R·T (1.1)
Постоянная R не зависит от состояния газа, она является индивидуальной для каждого газа и называется газовой постоянной. Уравнение (1.1) записано для 1кг газа и получено Клапейроном в 1884 г. Для М кг газа это уравнение имеет вид:
р V = M·R·T, (1.2)
где V – объем, занимаемый массой M кг газа.
Умножив правую и левую части (1.1) на молекулярную массу μ, получим уравнение состояния идеального газа для одного моля
р υ μ = R μ T, (1.3)
где υ μ = υ · μ, R μ = R · μ. Если в газе содержится N молей, то
p·V = N R T (1.3*)
Известно, что различные идеальные газы при одинаковых p и T имеют равные объемы одного моля υ μ. В частности, при стандартных условиях (p0 = 101 325 Па; T0 = 273,15 К) имеем υ μ = 22,414м3/к моль. Следовательно, величина R μ не зависит от природы газа и является одинаковой для всех газов. Она называется универсальной газовой постоянной.
|
|
|
Величину R μ можно определить, если в уравнение (1.3) подставить указанные выше значения р, T и υ μ. Тогда можно получить R μ = 8314,4 Дж/(к моль·К). Универсальная газовая постоянная в уравнении состояния идеального газа впервые была введена Д.И.Менделеевым. Уравнение состояния в форме (1.3) и (1.3*) принято называть уравнением Менделеева – Клайперона.
Таблица 1.1 Значения газовой постоянной R для некоторых газов (Дж/(кг·К))
| Газ | Не | Аr | H2 | N2 | O2 | CO | NO | CO2 | H2O | Воздух |
| R | 208,1 | 296,7 | 259,9 | 296,8 | 277,1 | 188,9 | 461,5 | 287,05 |
По величине R μ может быть найдена величина газовой постоянной любого газа (табл. 1.1), если известна его молекулярная масса:
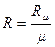 . (1.4)
. (1.4)
Хотя уравнения (1.1) – (1.3) строго применимы лишь к идеальным газам, но они с достаточной точностью могут быть применены для решения многих технических задач при определении свойств газов и расчете термодинамических процессов в реальных энергетических установках.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 665; Нарушение авторских прав?; Мы поможем в написании вашей работы!