
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость газа
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС
Изменение состояния системы (тела), сопровождающееся изменением ее параметров, называется термодинамическим процессом. Все термодинамические процессы разделяются на равновесные и неравновесные.
Равновесным называется термодинамический процесс, который представляет собой непрерывную последовательность равновесных состояний. Следовательно, в равновесном процессе в каждый момент давление и температура во всех точках системы одинаковы. Неравновесным называется термодинамический процесс, представляющий собой последовательность состояний, среди которых хотя бы один процесс не является равновесным.
Реальные процессы, протекающие в природе и во всех технических устройствах, являются неравновесными. Это объясняется тем, что изменение состояния системы, представляющее собой термодинамический процесс, может быть осуществлено только за счет внешнего воздействия, т.е. нарушения равновесия. Можно представить такие условия протекания реальных процессов, когда они становятся практически равновесными (или квазистатическими). Очевидно, что в этом случае нарушение равновесия в системе должны быть бесконечно малым, что может быть достигнуто медленным изменением состояния системы, т.е. медленным протеканием процесса.
Пример. Рассмотрим сжатие газа в цилиндре с поршнем. При движении поршня в первую очередь будут сжиматься слои газа, которые непосредственно прилегают к поверхности поршня; поэтому давление в этих слоях газа выше среднего значения давления газа в цилиндре. Поэтому, в процессе сжатия давление газа в цилиндре неодинаково и сам процесс является неравновесным.
Передача возмущений (изменение давления, вызванное перемещением поршня) происходит с конечной скоростью, которая равна скорости звука а. Если скорость перемещения поршня w п намного мала по сравнению со скоростью звука а, то в каждый момент времени давление газа успевает выравниваться по всему объему цилиндра и процесс будет квазистатическим; в то же время, при соизмеримых значениях w п и а процесс будет неравновесным.
Таким образом, равновесный процесс является предельным случаем неравновесного процесса при стремлении скорости последнего к нулю. Замена реального процесса равновесным позволяет при его исследовании использовать термодинамические уравнения и методы анализа, полученные для равновесных процессов, что дает достаточно точные результаты.
Термодинамические расчеты базируются на теплоемкости, которая представляет собой количество теплоты, которое необходимо для изменения температуры тела на один градус. Теплоемкость 1 кг вещества называют удельной с, а 1 моля – мольной с μ. В расчетах используют как величину истинной теплоемкости
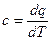 , (1.5)
, (1.5)
так и величину средней теплоемкости в заданном интервале температур (Т 2 – Т 1)
 (1.6)
(1.6)
где q – теплота, подведенная к 1 кг вещества при изменении его температуры от Т 1 до Т 2. В общем случае теплоемкость зависит от типа термодинамического процесса, рода газа и параметров состояния.
1.5.1 Влияние типа процесса на теплоемкость. В разных термодинамических процессах в одном и том же диапазоне изменения температуры теплота процесса может быть неодинакова, а, следовательно, неодинакова и теплоемкость.
В термодинамических расчетах наиболее часто используют теплоемкости изобарного с р и изохорного с υ процессов. Для одного и того же газа величина с υ всегда меньше теплоемкости ср, поскольку в первом случае теплота тратится лишь на изменение температуры газа, а во втором – также и на совершение работы. Теплоемкости с р и с υ идеального газа связаны между собой уравнением Майера, которое известно из курса общей физики:
с р – с υ = R, (1.7)
или
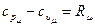 (1.8)
(1.8)
1.5.2 Влияние рода газа на теплоемкость. Из кинетической теории газов известно, что:
 ,
,  , (1.9)
, (1.9)
и
 ,
,  , (1.10)
, (1.10)
где y – число степеней свободы движения молекул. Поскольку в кинетической теории газов рассматриваются только поступательные и вращательные степени свободы, то этом случае для одноатомного газа y = 3, для двухатомного y = 5 и трехатомного y = 6.
Из сказанного следует, что мольная теплоемкость газа зависит от числа атомов в молекуле, а удельная – также от молекулярной массы (табл. 1.2). Кинетическая теория качественно хорошо описывает влияние y и μ на теплоемкость газа, однако количественно данные, полученные по уравнениям (1.9) и (1.10), хорошо согласуются с опытными данными только для одноатомных газов (табл. 1.2). Последнее связано с тем, что у многоатомных газов имеют место колебания атомов, энергия которых не учитывается в кинетической теории газов.
Таблица 1.2 Теплоемкость с р (кДж/кг·К) и с рμ (кДж/кмоль·К)
|
|
Дата добавления: 2014-12-27; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!