
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики
|
|
|
|
И ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Закон сохранения и превращения энергии указывает, что энергия не исчезает и не возникает, она лишь переходит из одного вида в другой в строго эквивалентных количествах. Важно подчеркнуть, что закон сохранения и превращения энергии утверждает не сохранение энергии вообще, а ее сохранение при превращениях из одной формы в другую.
Первый закон термодинамики представляет собой частный случай закона сохранения и превращения энергии в приложении к тепловым процессам в термодинамических системах. Из первого закона термодинамики следует, что если система (тело) является изолированной, т.е. она не обменивается энергией с окружающей средой, то ее внутренняя энергия не изменяется. Иначе говоря, внутренняя энергия изолированной системы постоянна. Изменение энергии системы (тела) возможно лишь при энергообмене с окружающей средой, т.е., при подводе (или отводе) к термодинамической системе теплоты или работы.
Изменение энергии системы приводит к изменению ее состояния. Следовательно, каждому состоянию системы соответствует вполне определенная величина внутренней энергии. Таким образом, внутренняя энергия системы является однозначной функцией ее состояния.
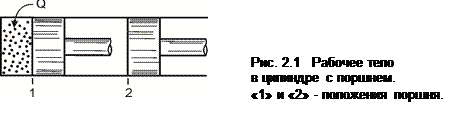
Рассмотрим подвод теплоты Q к рабочему телу, находящемуся в цилиндре с поршнем (рис. 2.1). Рабочее тело при расширении перемещает поршень из положения 1 в положение 2 и совершает работу L против внешних сил. Полный обмен энергией между рабочим телом и окружающей средой равен Q – L, а вся энергия равна изменению внутренней энергии рабочего тела:
Q – L = Δ U,
или
Q = Δ U + L, (2.1)
где Δ U = U 2 – U 1; U 1 и U 2 – величина внутренней энергии рабочего тела в начальном и конечном состояниях.
|
|
|
 |
Соотношение (2.1) представляет собой математическое выражение первого закона термодинамики в общей форме. Из него следует, что если в каком-либо процессе тело получает (или отдает) теплоту Q, совершает работу L с изменением внутренней энергии на величину Δ U, то алгебраическая сумма этих величин должна равняться нулю. Если в уравнении (2.1) все величины отнести к 1 кг массы рабочего тела, то получим следующее уравнение:
q = Δ u + l, (2.2)
или в дифференциальной форме:
dq = du + dl. (2.3)
В курсе общей физики математическая запись уравнения (2.3) используется в следующем виде:
δq = dU + δl.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!