
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
АЛКИНЫ
АЛКЕНЫ
Углеводороды, содержащие двойную связь, являются гомологами простейшего алкена, этилена, и по первому члену этого ряда называются этиленовыми углеводородами. Общая формула этого ряда СnH2n.
В соответствии с правилами ИЮПАК алкен получает название алкана, в котором окончание - ан меняется на суффикс -ен, при этом цепь нумеруется таким образом, чтобы атомы углерода, образующие двойную связь, получали наименьший номер:
Н3С-СН2-СН=СН2 бутен - 1
В случае разветвленных алкенов радикалы называются и нумеруются как и в случае алканов. Для некоторых простейших алкенов широко используются тривиальные названия, как уже упомянутый этилен, давший названию всего ряда алкенов, пропилен, бутилены.
CH2=CH2 этилен CH3-CH=CH2 пропилен
Широко используются тривиальные названия и простейших алкенильных радикалов, например:
CH2=CH- винил CH2=CH- CH2- аллил.
Для алкенов помимо изомерии углеродного скелета появляется еще и изомерия, связанная с положением двойной связи. Так, для алкена C4H8 возможны три изомера:
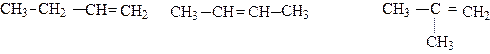 |
бутен-1 бутен-2 2-метилпропен-2
 |
Для алкенов характерна цис,- транс- изомерия. Вследствие затрудненного вращения вокруг двойной связи алкены, содержащие разные заместители при двойной связи, могут существовать в виде двух изомеров, отличающихся друг от друга только различным расположением заместителей при двойной связи, например:
транс -бутен-2 цис -бутен-2
Физические свойства алкенов близки к свойствам соответствующих алканов. Обычно алкены имеют более низкие температуры кипения и плавления по сравнению с алканами. Алкены не растворимы в воде, но они хорошо растворимы в органических растворителях.
|
|
|
Химические свойства алкенов.
Химические свойства алкенов определяются наличием в их молекулах двойной связи, p-связи. Для разрыва этой связи требуется значительно меньше энергии, чем для разрыва s- связи. Так, энергия разрыва С-С связи равна 339 кДж /моль, энергия разрыва С = С связи равна 611кДж/моль, то энергия разрыва p-связи составляет 272 кДж/моль. Более того, p - электроны значительно легче поляризуются, чем σ-электроны. Высокая электронная плотность двойной связи, легкая поляризуемость и небольшая энергия диссоциации объясняет то, что для алкенов наиболее характерными реакциями являются реакции присоединения, при этом из-за высокой нуклеофильности алкенов для них наиболее характерны реакции электрофильного присоединения (AE). Следовательно, алкены являются значительно более реакционноспособными соединениями по сравнению с алканами и, используя реакции присоединения, из алкенов можно получать большое разнообразие органических соединений. Так, наиболее характерными реакциями алкенов являются следующие:
 |
Рассмотрим механизм некоторых реакций. Алкены присоединяют галогены с образованием 1,2-дигалогеналканов. Обесцвечивание бромной воды является качественной реакцией на двойную связь. Установлен механизм этой реакции как реакции электрофильного присоединения по двойной связи(AE). Общая схема реакции:
 |
Однако это только суммарный итог реакции. Реакция проходит ступенчато, через несколько стадий:
1.Образование p - комплекса.
При приближении галогена к π- связи молекула галогена поляризуется и своим положительным концом атакует алкен, вытягивая на себя подвижные π-электроны двойной связи, образуя неустойчивый p - комплекс:
 |
π- комплекс
2.Образование галогенониевого иона.
Неустойчивый p - комплекс превращается в “ониевый” ион вследствие того, что электрофил присоединился одновременно к двум атомам углерода с образованием циклического интермедиата:
|
|
|
 |
π- комплекс циклический ион бромония
3. Нуклеофильная атака галогенониевого иона.
Нуклеофил атакует галогенониевый ион со стороны, противоположной к уже имеющемуся в нем атому галогена, в результате образуется продукт реакции транс - присоединения:
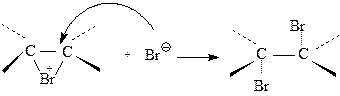 |
При бромировании циклогексена образуется транс-1,2-дибромциклогексан:
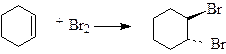 |
Этот результат подтверждает транс-присоединение и служит доказательством того, что реакция протекает в несколько стадий.
Реакция присоединения кислот (H2SO4, HHal), воды в кислой среде протекает по другому механизму. В этом случае реагент НХ (Х=НSO4-, Hal-, H2O) диссоциирует на ионы.
Механизм этих реакций включает атаку протоном (H+) электронов π-связи алкена с образованием σ-связи с атомом углерода, в результате чего положительный заряд переходит на соседний атом углерода. Ионы, в которых положительный заряд находится на атоме углерода, называются карбкатионами. Такие ионы являются химически очень активными, так как для углерода нехарактерно заряженное состояние. Они тут же реагируют с анионом кислоты, давая конечный продукт присоединения.
Схема реакции электрофильного присоединения (AE) кислоты к алкену:
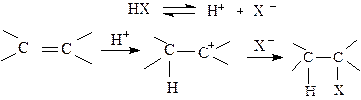 |
Алкен карбкатион продукт реакции
В случае несимметричных алкенов эта реакция приводит к получению одного из двух возможных изомеров, т.е. является региоселективной. Региоселективными называются реакции, приводящие к получению одного из нескольких возможных изомерных продуктов.
В случае, если к несимметричному алкену присоединяется несимметричная молекула, то возможно образование двух продуктов, но получается, как правило, один. Реакция может осуществляться по двум направлениям:
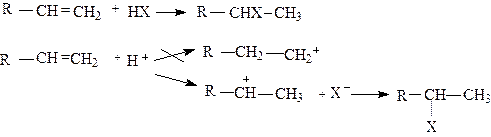 |
Фактором, определяющим направление присоединения, является устойчивость того или иного промежуточного карбкатиона, в стабилизации которого участвуют алкильные или арильные заместители, соединенные с атомом углерода, несущим положительный заряд. Чем устойчивее катион, тем ниже его энергия и, следовательно, тем легче он образуется. Относительная устойчивость карбкатионов следующая:
|
|
|
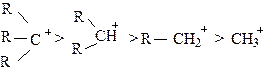 |
R= алкил, арил
При электрофильном присоединении к алкену образуется тот продукт, который получается из более стабильного карбкатиона, например, как в приведенной выше схеме, RCHX-CH3. Это наблюдение было обобщено эмпирически открытым Марковниковым правилом: присоединение галогеноводородов, воды в присутствии сильных минеральных кислот к алкенам происходит так, что атом водорода присоединяется к тому атому углерода, с которым уже связано большее число атомов водорода, т.е. к наиболее гидрогенизированному.
В настоящее время в связи с учетом электронных факторов заместителей в молекуле алкена направление присоединения реагентов типа HX определяется относительной устойчивостью промежуточно образующихся карбкатионов. Так, при действии на алкен, содержащий электроноакцепторную группу, галогеноводородной кислоты присоединение последней идет против правила Марковникова:
Например:
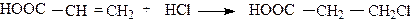 |
Если подвести итог рассмотренных реакций, то можно сказать, что реакция электрофильного присоединения протекает тем легче, чем сильнее электрофильный агент. Например, в ряду галогеноводородных кислот чем сильнее кислота, тем сильнее электрофил:
HI > HBr > HCI
Строение алкена также оказывает влияние на скорость реакции электрофильного присоединения: чем выше электронная плотность на двойной связи, тем выше скорость присоединения. Заместители, обладающие электронодонорными свойствами, способствуют ускорению реакции, например:
 |
Полимеризация алкенов.
Алкены могут быть полимеризованы до соединений с высокой молекулярной массой нагреванием их в присутствии свободнорадикальных катализаторов. Такая полимеризация происходит по радикальному механизму. В качестве инициатора для проведения радикальной полимеризации используют пероксидные соединения или другие вещества, способные служить источниками свободных радикалов.
 |
и т.д.
Полимеризация – это цепная реакция, важная для получения политена (полиэтилена), полипропена (полипропилена), полистирола. Полимеризацию алкенов можно проводить с такими катализаторами, как кислоты, основания или металлоорганические соединения. Так, полимеризация этена и пропена в настоящее время проводится с использованием катализатора Натта-Циглера, состоящего из (C2H5)3Al и TiCI4 .При использования такого катализатора можно получать полимеры с очень регулярной структурой, так называемые изотактические полимеры, в то время как при свободнорадикальной полимеризации получаются полимеры с беспорядочно ориентированными группами, например:
|
|
|
 |
Структура
изотактического и атактического
полипропилена
Алкины - углеводороды, содержащие в молекуле тройную связь. Для построения названия соединений с тройной связью по ИЮПАК тройная связь обозначается суффиксом “-ин,” например:
 |
бутин-2 3-метилбутин-1
Первый член гомологического ряда этин C2H2 сохранил свое тривиальное название - ацетилен.
Для алкинов возможна структурная изомерия, обусловленная изомерией углеродного скелета, изомерией положения тройной связи, и межклассовая (алкины и алкадиены). Так как атомы углерода, связанные тройной связью, имеют линейную структуру, то пространственная изомерия для алкинов не характерна. Физические свойства алкинов близки к свойствам алкенов: нерастворимы в воде и хорошо растворяются в органических растворителях.
Строение.
В алкинах атомы углерода находятся в состоянии sp- гибридизации. Две σ- связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180о друг к другу. Две p-связи образованы при перекрывании двух пар негибридных 2р орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной σ- и двух π- связей.
Алкины вступают в большинство реакций, характерных для алкенов. Так, алкины вступают в реакции электрофильного присоединения. Механизмы этих реакций аналогичны механизмам соответствующих реакций алкенов. Отличие состоит в том, что в зависимости от условий алкин может присоединять одну или две молекулы галогеноводородных кислот и галогенов, тогда как алкен - одну. В этих реакциях алкины в общем менее активны, чем алкены. Это объясняется тем, что sp-гибридизованные орбитали более электроотрицательны (больший вклад s- орбитали), π - электроны более прочно связаны с ядром, и, следовательно, менее активно реагируют с электрофильным агентом. Например обесцвечивание бромной воды и изменение окраски раствора перманганата калия алкинами происходит медленнее (алкены в тех же условиях реагируют практически мгновенно). Многие реакции электрофильного присоединения к алкинам происходят лишь в присутствии катализаторов. Вторая особенность алкинов - это повышенная полярность ацетиленовой связи С _ Н. Она обусловлена следующими причинами. Известно, что 2s -электроны в среднем расположены ближе к ядру, чем 2 р -электроны. При переходе от sp3- к sp2- и далее к sp-гибридизации вклад s-орбитали в образование гибридных орбиталей увеличивается-, растет “s-характер “ последних. Вследствие этого электроны связей, образованных sp-гибридными орбиталями атома углерода, находятся ближе к его ядру, чем связи, образованные sp2- и, тем более, sp3-гибридными орбиталями. Это означает, что электроотрицательность углерода увеличивается при изменении гибридизации от sp3 к sp2 и sp Полярность ацетиленовой связи C-H-связи приводит к наличию у алкинов-1 очень слабых кислотных свойств.
Алкины, как и алкены, легко окисляются и вступают в реакции полимеризации.
Химические свойства ацетиленов.
1.Гидрирование алкинов.
Большинство реакций присоединения к алкинам идут ступенчато. При присоединении одной молекулы водорода к тройной связи получается соответствующий алкен. Дальнейшее восстановление приводит к алкану. Гидрирование идет в присутствии катализаторов (Pt,Pd,Ni):
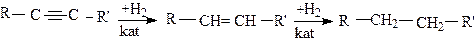 |
2. Присоединение галогенов.
Галогены присоединяются к алкинам; в реакцию может вступать один моль или два моль агента. При присоединении 1 моль брома к ацетилену образуется единственный продукт - транс-1,2-дибромэтен, что является дополнительным подтверждением механизма этой реакции как реакции электрофильного присоединения (АЕ):
 |
транс-1,2-дибромэтен
3.Гидрогалогенирование.
 |
Присоединение галогеноводородных кислот к тройной связи происходит труднее, чем к двойной. Для активации реакции используется AlCl3 - сильная кислота Льюиса. Из ацетилена при этом можно получить винилхлорид(хлорэтен), который используется для получения полимера-поливинилхлорида.
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
 |
4.Гидратация.
Важной реакцией алкинов является гидратация тройной связи, катализируемая кислотой и солями ртути. При этом из aцетилена получается этаналь:
 |
другие алкины дают кетоны:
 |
Предполагается, что на первой стадии присоединения воды (по правилу Марковникова) образуются неустойчивые виниловые спирты, так называемые енолы, которые быстро изомеризуются в более стабильные карбонильные соединения. Реакция гидратации алкинов была открыта русским химиком М.Г.Кучеровым и носит его имя.
5.Кислотные свойства алкинов.
Особенностью алкинов по сравнению с алкенами является то, что, как уже указывалось, атомы водорода алкинов с концевой тройной связью обладают слабыми кислотными свойствами, однако, значительно более слабыми, чем вода. Поэтому со щелочами ацетилены не реагируют. Отщепить водород от ацетилена можно более сильными основаниями, такими, как амид натрия, например:
 |
При взаимодействии терминальных алкинов с солями ртути(2),меди(1),серебра образуются нерастворимые соли (ацетилениды), например:
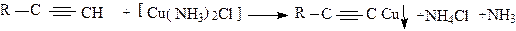 |
Образование темно-красного осадка соли меди служит качественной реакцией на подвижный водород ацетиленов.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1687; Нарушение авторских прав?; Мы поможем в написании вашей работы!