
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Граница электрод-раствор
|
|
|
|
Электрические и адсорбционные явления на границе раздела фаз. Двойной электрический слой.
Способы защиты
Пассивность металлов
Водородная и кислородная деполяризация
Электрохимическая коррозия и способы защиты металлов от коррозии.
• Коррозия – самопроизвольное разрушение металлов и сплавов под действием окружающей среды.
• Коррозия наносит большой экономический ущерб в результате безвозвратных потерь металла, преждевременного выхода и строя оборудования и т.д.
Классификация:
• Химическая коррозия – заключается в протекании химической реакции между металлами и сухими агрессивными газами, а также неэлектролитами.
• Электрохимическая коррозия – обусловлена протеканием электрохимических процессов. Встречается наиболее часто в водоемах, почве, влажной атмосфере.
• Биохимическая коррозия – вызвана жизнедеятельностью живых организмов. Сочетается с другими видами коррозии.
• Коррозия связана с протеканием катодных реакций восстановления водорода или кислорода.
• В кислой среде при ограниченном доступе кислорода имеет место коррозия с выделением водорода, или коррозия с водородной деполяризацией:
H+ + e- = ½ H2
• При значительном доступе кислорода протекает коррозия с поглощением кислорода, или коррозия с кислородной деполяризацией:
O2 + 2H2O + 4e- = 4OH-
• Состояние повышенной коррозионной устойчивости металлов в таких условиях, когда термодинамически возможно их взаимодействие с веществами, находящимися в окружающей среде, называется пассивным.
• Примеры: Fe в H2SO4(конц.), Al на воздухе, Ni в щелочных растворах.
• Пассивность металлов связана с образованием на их поверхности защитных пленок в результате образования малорастворимых химических соединений или адсорбции веществ.
|
|
|
• Повышение коррозионной стойкости самого материала путем нанесения химической модификации или нанесения химических покрытий
• Снижение агрессивности коррозионной среды, в первую очередь, путем удаления O2, CO2 и введения ингибиторов.
• Нанесение изолирующих покрытий – лакокрасочных, полимерных, конверсионных (оксидов, фосфатов, хроматов).
• Регулирование электродного потенциала защищаемого материала
• Катодная защита – отрицательный потенциал накладывается на защищаемый материал за счет внешнего источника тока или создания цепи с более электроотрицательного металла
• Анодная защита применяется к металлам, которые пассивируются при их поляризации внешним анодным током.
• Детальное знание факторов, влияющих на скорость переноса электронов на электродах помогает лучше понять процесс получения электроэнергии в гальванических элементах, электропроводность металлов, полупроводников и электронных приборов микро- и нанометрового размера.
• Эффективность используемых в настоящее время технологий может быть существенно улучшена при
– совершенствовании методов производства электроэнергии
– разработке новых методов защиты от коррозии
• Оба этих направления развития требуют знаний о кинетике электродных процессов
• При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.
• Говорят, что образовался двойной электрический слой (д.э.с.)
• Образование двойного электрического слоя может быть вызвано разными причинами:
– Смещением электронной плотности металла на границе
– Адсорбцией ионов противоположного знака
– Ориентацией молекул растворителя вблизи поверхности электрода
– Специфической адсорбцией неэлектролитов из раствора
|
|
|
• Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)
7.1) Электрические и адсорбционные явления на границе раздела фаз. Уравнение Гиббса. Поверхностное натяжение (обратимая поверхностная работа). Двойной электрический слой.

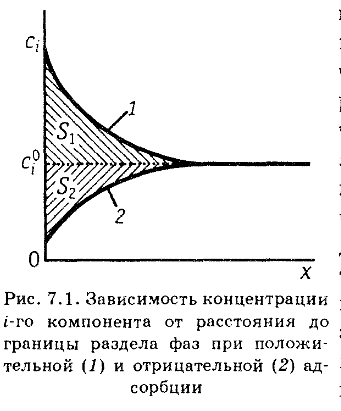
• 
 При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.
При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.
• Говорят, что образовался двойной электрический слой (д.э.с.)
• Образование двойного электрического слоя может быть вызвано разными причинами:
– Смещением электронной плотности металла на границе
– Адсорбцией ионов противоположного знака
– Ориентацией молекул растворителя вблизи поверхности электрода
– Специфической адсорбцией неэлектролитов из раствора
• Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)

7.2) Электрокапиллярные явления, капиллярный электрометр. Уравнение липпмана.






7.3) двойной электрический слой. Его емкость. Импеданс.



7.4) Модели строения двойного электрического слоя. Теория гельмгольца, Гуи-Чепмена, Штерна. Современные представления
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 952; Нарушение авторских прав?; Мы поможем в написании вашей работы!