
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углерод, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода
Натрий, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома. Физические и химические свойства; взаимодействие с неметаллами, водой.
Оксиды, их классификация и химические свойства (отношение к воде, кислотам, щелочам).

Следует обратить внимание на то, что к кислотным оксидам, помимо оксидов неметаллов, могут относиться также и оксиды металлов с валентностью больше трех (например, оксид хрома (VI)).
Примеры несолеобразующих оксидов учащийся приводит по желанию: СО, NO.
Разложение солей, кислот и нерастворимых оснований:

Аналогично основным оксидам рассматривают химические свойства кислотных оксидов и составляют соответствующие уравнения реакций, обратив внимание на взаимодействие кислотных оксидов с основными:

Свойства амфотерных оксидов можно (по желанию) рассмотреть на примере оксида алюминия:
1) реагирует с кислотами (как основные оксиды):

2) реагирует с основаниями (как кислотные оксиды):
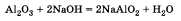
По желанию учащийся может рассказать о взаимодействии основных и амфотерных оксидов с водородом (Н2) (на примере оксида меди II):

24. Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки.
Ядро образовано протонами и нейтронами.
Протон — это частица, имеющая положительный заряд (+1).
Нейтрон — это нейтральная частица, заряд ее равен 0.
Из определений следует, что величина заряда ядра атома равна числу протонов и имеет положительное значение.
Электронная оболочка образована электронами, заряд у которых отрицательный. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица).
Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
Далее следует отметить, что практически вся масса атома сосредоточена в ядре. Это связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают).
Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
На каждом электронном слое может располагаться определенное число электронов: на первом — не больше двух, на втором — не больше восьми, на третьем — не больше восемнадцати.
Число электронных слоев определяется по номеру периода, в котором расположен химический элемент.
Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента.
Так, например, кислород расположен во втором периоде VI группы. Из этого следует, что у него два электронных слоя и на внешнем (втором) расположено шесть электронов.
Электронные слои заполняются у атомов постепенно, по мере увеличения общего числа электронов, которое соответствует порядковому номеру химического элемента. В сумме на первых двух электронных слоях может располагаться не более 10 электронов, т. е. элементом, завершающим второй период, является неон (Ne).
У атомов третьего периода в атоме находится три электронных слоя. Первый и второй электронные слои заполнены электронами до предела. Для первого представителя элементов третьего периода натрия схема расположения электронов в атоме выглядит так:

Из схемы видно, что атом натрия имеет заряд ядра +11. Электронную оболочку атома составляют 11 электронов. На первом электронном слое находится два электрона, на втором — восемь, а на третьем — один электрон. У магния, как элемента II группы этого периода, на внешнем электронном слое находится уже два электрона:

Для остальных элементов периода изменение строения атома происходит аналогично. У каждого последующего элемента, в отличие от предыдущего, заряд ядра больше на одну единицу и на внешнем электронном слое расположено на один электрон больше. Число электронов, располагающихся на внешнем электронном слое, равно номеру группы.
Завершает период аргон. Заряд его ядра +18. Это элемент VIII группы, поэтому на внешнем электронном слое его атома находится восемь электронов:
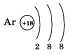
Далее можно сделать выводы и об изменении свойств элементов в периоде.
Любой период (кроме первого) начинается типичным металлом. В третьем периоде это натрий Na. Далее следует магний Mg, также обладающий ярко выраженными металлическими свойствами. Следующий элемент в периоде — алюминий А1. Это амфотерный элемент, проявляющий двойственные свойства (и металлов и неметаллов). Остальные элементы в периоде — неметаллы: кремний Si, фосфор Р, хлор С1. И заканчивается период инертным газом аргоном Аг.
Таким образом, в периоде происходит постепенное ослабление металлических свойств и возрастание свойств неметаллов. Такое изменение свойств объясняется увеличением числа электронов на внешнем электронном слое: от 1 — 2, характерных для металлов, и заканчивая 5 — 8 электронами, соответствующими элементам-неметаллам.
В периодической таблице химических элементов натрий Na расположен в третьем периоде I группы главной подгруппы.
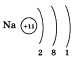
Рассказывая о строении атома натрия, учащийся должен изобразить распределение электронов по электронным слоям:
Однако по желанию учащийся может расширить свой ответ информацией о составе атома графической схемой и электронной формулой:

Натрий — металл. Основная степень окисления +1. Натрий образует оксид Na2O и гидроксид NaOH, которые проявляют основные свойства.
При освещении вопроса о нахождении натрия и его соединений в природе необходимо отметить, что как простое вещество натрий в природе не встречается из-за высокой химической активности. Получают натрий из расплава хлорида или гидроксида натрия при прохождении через него электрического тока.
Натрий — серебристо-белый металл, с небольшой плотностью, легкоплавкий, легко окисляется на воздухе.
При характеристике химических свойств необходимо отметить, что натрий, как и другие щелочные металлы, чрезвычайно активный металл. Это происходит потому, что он легко отдает единственный электрон, находящийся на внешнем электронном слое.
Далее можно рассмотреть его взаимодействие: а) с простыми веществами; б) со сложными веществами.

При записи уравнений реакций со сложными веществами необходимо помнить, что в растворах кислот натрий сначала реагирует с водой (см. реакцию выше), а потом уже идет реакция между щелочью и кислотой:

Закончить ответ можно рассказом о применении натрия.
Применение натрия как металла связано с его восстановительными свойствами; он используется в качестве катализатора в органической химии, газа-наполнителя в светильниках, в виде сплава с калием — как хладагент в ядерных реакторах-размножителях на быстрых нейтронах. Мировое ежегодное потребление натрия и его соединений превосходит 100 млн т.
Наиболее важные соединения натрия, применяемые в быту и на производстве, — бикарбонат натрия NaHCO3, карбонат натрия Na2CO3, гидроксид натрия NaOH, раствор силиката натрия Na2SiO3 (жидкое стекло) — силикатный клей.
26. Задача. Какую массу оксида углерода (IV) необходимо взять для получения 2 моль карбоната кальция?

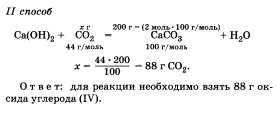
В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы.
Рассказ о строении атома углерода следует начать с изображения распределения электронов по электронным слоям:

По желанию учащийся может дополнить свой ответ информацией, приведя состав, графическую схему и электронную формулу атома углерода:

Углерод (С) — неметалл. Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства.
При освещении вопроса о нахождении углерода в природе и характеристике физических свойств углерода следует остановиться на явлении адсорбции (поглощение одного вещества поверхностью другого). Вещество, на поверхности которого происходит поглощение, называется адсорбентом. Вследствие большой пористости древесный уголь является хорошим адсорбентом, т. е. способен поглощать своей поверхностью большие порции веществ (например, газов). Это свойство угля используется в медицине (активированный уголь), на этом основано использование угля в противогазах.
Среди аллотропных модификаций следует рассмотреть алмаз и графит. Следует отметить, что различие физических свойств алмаза и графита обусловлено строением их кристаллических решеток. Необходимо показать, что графит и алмаз превращаются друг в друга, при этом целесообразно воспользоваться схемой:
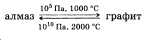
О других видоизменениях углерода (карбин, фулле-рен) ученик может рассказать по желанию.
Рассказ о химических свойствах углерода можно начать с анализа строения атома. Наличие четырех электронов на внешнем электронном слое (валентных электронов) предполагает возможность как принятия, так и отдачи этих электронов. Из этого следует, что углерод по химическим свойствам может быть: а) окислителем (например, в реакциях с металлами и водородом):

Эта реакция играет важную роль в металлургии (получение чистых металлов).
Далее следует перейти к сравнительной характеристике двух оксидов, образуемых углеродом: оксид углерода (II) и оксид углерода (IV). Для удобства ответ можно представить в виде таблицы.
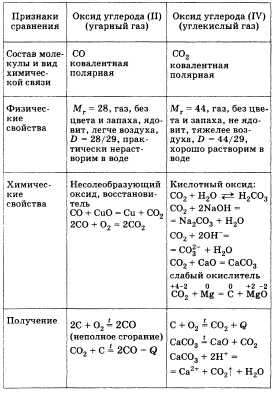
Оба оксида имеют важное значение: СО — в металлургии, получение метилового спирта; СО2 — в процессе фотосинтеза, получение мочевины (удобрения). Оба являются составной частью круговорота углерода в природе.
28. Задача. Какая масса хлорида железа (III) образуется при взаимодействии хлорида железа (II) с 4 моль хлора?

|
|
Дата добавления: 2015-04-24; Просмотров: 4638; Нарушение авторских прав?; Мы поможем в написании вашей работы!