
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции. Окислитель и восстановитель
|
|
|
|
Классификация химических реакций.
Взаимосвязь между классами неорганических веществ.
Простые и сложные неорганические вещества, их состав и классификация.
Ответом на этот вопрос может служить схема, в основе которой лежит классификация веществ по количественному и качественному составу.
Используя схему, необходимо кратко охарактеризовать вещества простые и сложные, состав веществ различных классов, привести примеры.
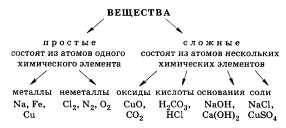
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Кислоты — это электролиты, при диссоциации которых из положительных ионов образуются только ионы водорода (Н+).
Основания — это электролиты, при диссоциации которых из отрицательных ионов образуются только гидроксид-ионы (ОН-).
Соли — это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотного остатка.
Далее следует привести уравнения реакций, характеризующие основные свойства каждого класса соединений.
Для оксидов таким свойством является взаимодействие с водой:

Характерным свойством солей является взаимодействие друг с другом:
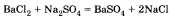
В заключение важно показать, что причинами многообразия веществ являются их: а) качественный состав; б) количественный состав.
В настоящий момент известно более 50 тыс. неорганических и несколько миллионов органических соединений, в то время как открыто лишь 114 химических элементов. Это объясняется тем, что атомы могут соединяться в разной последовательности и в разном количественном соотношении. Так, например, азот может образовывать пять оксидов: N2O; NO; N2O3; NO2, N2O5. А сера входит в состав 11 кислот.
Другая причина многообразия заключается в том, что некоторые химические элементы могут образовывать несколько простых веществ. Такое явление получило название аллотропия, а простые вещества — аллотропные видоизменения. Например, видоизменения кислорода, углерода и фосфора соответственно: кислород О2 и озон О3; графит, алмаз,
карбин, фуллерен; белый, красный, черный.
Различие в свойствах объясняется разным порядком связи атомов в молекулах и их расположением в пространстве, т. е. химическим строением.
|
|
|
9. Задача. Какой объем оксида углерода (IV) выделится при н. у. в результате взаимодействия соляной кислоты массой 7,3 г и карбоната натрия?


При ответе важно показать единство мира неорганических веществ. Для этого можно использовать схемы, отражающие связи между классами неорганических веществ, а затем записать уравнения химических реакций, подтверждающих эти связи.
Схемы могут быть, например, такими:

При составлении уравнений химических реакций необходимо давать названия веществам и указывать, к каким классам неорганических соединений они относятся
тов реакции; б) выделение или поглощение теплоты; в) изменение степени окисления химических элементов; г) наличие или отсутствие катализатора; д) обратимость реакций.
а) По числу и составу исходных веществ и продуктов реакции химические реакции можно разделить на следующие типы: разложение; соединение; обмен; замещение
Разложение — это реакция, в результате которой из одного вещества получается несколько.
Разложению могут быть подвергнуты некоторые соли, кислоты, оксиды и основания (прежде всего нерастворимые):
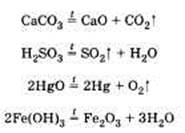
Соединение — это реакция, в результате которой из нескольких веществ получается одно. Например, сера соединяется с железом; многие кислотные и основные оксиды соединяются с водой или друг с другом:
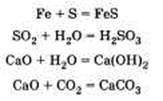
Обмен — это реакция между сложными веществами, в результате которой они обмениваются своими составными частями. Обмен наиболее характерен для ионных реакций. Например, реакция нейтрализации НСl + NaOH = NaCl + H2O; реакции между со-
лями СаСl2 + Na2CO3 = CaCO3 + 2NaCl и т. д.
Замещение — в неорганической химии к такому типу относят реакцию, в которую вступает сложное вещество и простое. В результате этой реакции образуется новое простое и сложное вещества. Например, железо замещает медь из ее хлорида Fe + CuCl2 = = Сu + FeCl2; натрий замещает водород из воды 2Na + 2Н20 = H2 + 2NaOH.
б) В зависимости от теплового эффекта реакции подразделяются на экзотермические и эндотермические.
Экзотермическими называют реакции, протекающие с выделением энергии:
2Mg + 02 = 2MgO + Q
Реакции, сопровождающиеся поглощением энергии, называют эндотермическими:
СаСО3 = СаО + СО2 - Q
Выделение или поглощение энергии может быть обозначено в уравнении реакции соответственно знаком +Q или -Q.
Реакции разложения обычно протекают с поглощением энергии, а присоединения — с выделением энергии.
в) Окислительно-восстановительными называют реакции, в результате которых некоторые элементы, входящие в состав исходных веществ и продуктов, меняют свои степени окисления. Например, окисление меди кислородом:
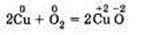
Замещение иона брома атомами хлора тоже является окислительно-восстановительной реакцией:
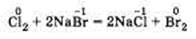
Есть реакции, идущие и без изменения степени окисления. Например, реакции ионного обмена:

г) Каталитические и некаталитические реакции. Реакции, идущие с участием катализаторов, называются каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут. Пример такой реакции — разложение пероксида водорода (протекает быстрее в присутствии оксида марганца (IV)):

д) Необратимые и обратимые реакции. Необратимые реакции протекают до полного превращения исходных веществ в продукты:

Признаками необратимости реакций в растворах является образование малодиссоциирующего вещества (осадка, газа или воды).
Обратимые реакции протекают как в сторону получения продуктов реакции, так и в сторону получения исходных веществ:
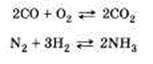
Важно отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например 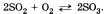 Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
|
|
|
|
|
|
Ответ можно начать с утверждения о том, что по изменению степени окисления химических элементов различают реакции окислительно-восстановительные и реакции, идущие без изменения степеней окисления (например, ионного обмена).
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными реакциями.
Рассмотрим с точки зрения этого признака пример:
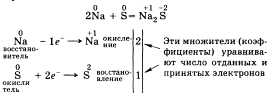
Частица (атом, ион), которая в ходе окислительно-восстановительного процесса отдает электроны, называется восстановителем. Процесс отдачи электронов — окисление. Восстановитель свою степень окисления повышает. В приведенном примере это натрий Na.
Частица, принимающая электроны, — окислитель, он восстанавливается и понижает степень окисления. В нашем случае это сера S.
Важно обратить внимание, что число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
В составе сложных веществ элементы могут иметь разные степени окисления. От этого зависит, окислителем или восстановителем является это вещество. Так, например, азотная кислота является окислителем. В состав азотной кислоты HNO3 входит азот, имеющий степень окисления +5, который в процессе окислительно-восстановительной реакции может только понижать свою степень окисления, принимая электроны.
Сероводород H2S — восстановитель за счет атома серы со степенью окисления -2.

13. Задача. Какая масса оксида углерода (IV) образуется при взаимодействии карбоната кальция с раствором соляной кислоты с массовой долей 8,3% и массой 100 г?

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 5024; Нарушение авторских прав?; Мы поможем в написании вашей работы!