
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация кислот, оснований, солей
|
|
|
|
Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение атомов (на примере углерода, азота, кислорода, фтора). Отличие физических свойств неметаллов от металлов. Взаимодействие неметаллов с простыми веществами (на примере реакций соединения серы с металлами, водородом и кислородом).
Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение атомов (на примере натрия, алюминия). Характерные физические и химические свойства металлов.
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера.
Экологические проблемы, связанные с производством серной кислоты, и способы их решения.
Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы (IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
Водород, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
Железо, его положение в периодической системе химических элементов Д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
Кальций, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома. Физические и химические свойства; взаимодействие с кислородом, водой, кислотами.
|
|
|
Углерод, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода.
Натрий, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома. Физические и химические свойства; взаимодействие с неметаллами, водой.
Оксиды, их классификация и химические свойства (отношение к воде, кислотам, щелочам).
24. Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
26. Задача. Какую массу оксида углерода (IV) необходимо взять для получения 2 моль карбоната кальция?
28. Задача. Какая масса хлорида железа (III) образуется при взаимодействии хлорида железа (II) с 4 моль хлора?
32. Задача. Какой объем кислорода и воздуха (н. у.) потребуется для сжигания 448 л метана СН4?
36. Задача. Вычислите, какой объем ацетилена С2Н2 (при н. у.) образуется в результате взаимодействия с водой 100 г технического карбида кальция (СаС2), содержащего 4% примеси. Уравнение реакции процесса: СаС2 + 2Н2О = Са(ОН)2 + С2Н2.
37. Круговорот химических элементов в природе (на примере одного из элементов: углерода или кислорода). Роль живых существ в круговороте химических элементов.
39. Получение металлов из оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (II). Роль металлов и сплавов в современной технике.
40. Задача. Определите количество вещества осадка гидроксида меди (II), образующегося при взаимодействии хлорида меди (II) и 10 г раствора гидроксида натрия, с массовой долей 8%.
До открытия Д. И. Менделеева в науке уже были предприняты попытки классифицировать химические элементы по определенным признакам.
Предшественники Д. И. Менделеева, отмечая сходство некоторых элементов, объединили их в отдельные группы или классы. Например, разделение элементов на два класса — металлы и неметаллы — оказалось неточным, потому что есть химические элементы с двойственными свойствами — как металлов, так и неметаллов.
Важным этапом в работе по созданию классификации химических элементов было объединение сходных элементов в естественные семейства, например щелочные металлы, галогены.
Однако все ученые, пытаясь классифицировать химические элементы, искали сходство между элементами одного семейства, но не могли себе представить, что все элементы тесно связаны друг с другом.
Гениальное подтверждение того, что все химические элементы взаимосвязаны, сделал выдающийся русский химик Д. И. Менделеев, который сравнил их на основе двух свойств: атомной массы и валентности, т. е. способности образовывать известные формы соединений (оксиды, водородные соединения и др.).
В 1869 г. он впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Это позже стало известно, что у атома есть ядро, которое имеет определенный заряд и массу. Причем чем больше заряд ядра, тем больше в нем содержится протонов и нейтронов. Это в конечном счете определяет взаимосвязь заряда атома и его массы. Чем больше заряд, тем, как правило, больше масса атома. Необходимо было обладать большой научной интуицией, чтобы, не зная состав атомного ядра, взять за основу систематизации элементов массу их атомов. Расположив известные элементы по мере увеличения массы их атомов, ученый обнаружил повторяемость свойств элементов, образующих одну большую последовательность.
Данные о строении атома подтвердили и объяснили периодическое изменение свойств химических элементов и теперь периодический закон формулируют так: Свойства простых веществ, а также формы, и свойства их соединений находятся в периодической зависимости от зарядов ядер атомов.
Периодическое изменение свойств химических элементов с точки зрения строения атомов можно объяснить так. Возрастание положительного заряда атомных ядер приводит к возрастанию числа электронов в атоме. Число электронов равно заряду ядра атома. Электроны же располагаются в атоме не как угодно, а по электронным слоям. Каждый электронный слой имеет определенное число электронов. По мере заполнения одного слоя начинает заполняться следующий. А поскольку от числа электронов на внешнем слое в основном зависят свойства элементов, то и свойства периодически повторяются.
В качестве примера можно рассмотреть накопление электронов на внешнем электронном слое атомов второго и третьего периодов. Каждый из периодов начинается с элементов, атомы которых на внешнем слое имеют один валентный электрон (Li, Na). Вследствие легкой отдачи этих электронов элементы проявляют сходные свойства и называются щелочными металлами.
В конце этих периодов находятся галогены, имеющие семь электронов на внешнем слое атомов, и инертные газы, у которых внешний слой завершен и содержит восемь электронов.
Таким образом, в каждом периоде с возрастанием заряда ядра металлические свойства элементов постепенно ослабевают, усиливаются неметаллические. Накопление восьми электронов на внешнем слое (инертные газы) и появление еще одного электрона у следующего атома приводит к резкому скачку в свойствах элементов и началу нового периода.
На основе периодического закона были систематизированы элементы, или, говоря иначе, построена периодическая система химических элементов. Графическое изображение этого закона называется периодической таблицей.
В таблице каждый химический элемент имеет атомный номер, который определяется числом протонов в ядре атома, т. е. атомный номер численно равен заряду ядра. Таким образом, основной признак, который определяет химический элемент, — это заряд его ядра. Массу атома в основном определяют протоны и нейтроны, составляющие ядро.
Периодом называется ряд элементов, расположенных в порядке возрастания атомных масс, начинающийся со щелочного металла (за исключением первого периода; он начинается с водорода) и заканчивающийся инертным газом. В первый период входят только два элемента, во второй и третий — по восемь (эти периоды называются малыми). Четвертый период образован восемнадцатью элементами, а пятый и шестой — еще большим числом элементов.
Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы как малых, так и больших периодов.
Побочные подгруппы образованы только элементами больших периодов. Например, в состав главной подгруппы II группы входят элементы второго и третьего периодов — бериллий Be и магний Mg. Побочная подгруппа начинается с элемента четвертого (большого) периода — цинка Zn. И еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот).
В малых периодах, как было отмечено выше, по мере увеличения атомного номера элемента наблюдается закономерное увеличение числа электронов, находящихся на внешнем электронном слое атомов элементов. Как следствие этого от щелочного металла к галогену уменьшаются металлические свойства элементов и увеличиваются неметаллические свойства. Эта же закономерность проявляется и в свойствах веществ, образованных этими элементами. Так, например, оксид лития проявляет основные свойства, оксид бериллия — амфотерные. Высшие оксиды остальных элементов являются кислотными (кислородное соединение фтора является не оксидом, а фторидом).
В главной подгруппе по мере увеличения атомного номера элемента наблюдается усиление металлических свойств элемента и уменьшение неметаллических.
Это можно объяснить следующим образом. У элементов V группы на внешнем электронном слое по пять электронов. Однако внешние электроны у атома висмута находятся дальше от ядра и поэтому слабее удерживаются около него. Поэтому атомы висмута могут отдавать электроны, иначе говоря, проявлять металлические свойства, что не характерно для азота.
Такая же закономерность в свойствах элементов и их соединений наблюдается в любой группе. Так, IV группа начинается с двух неметаллов — углерода С и кремния Si, далее следует германий Ge с промежуточными свойствами, и заканчивается группа оловом Sn и свинцом РЬ — металлами.
Изменяются в группах и свойства соединений: оксид углерода (IV) — кислотный оксид, а оксид свинца обладает основными свойствами.
Периодический закон позволил систематизировать свойства химических элементов и их соединений.
При создании периодической системы Д. И. Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и описал их свойства.
|
|
|
|
|
|
|
|
|
Металлы составляют большую часть химических элементов. Каждый период периодической системы (кроме 1-го) химических элементов начинается с металлов, причем с увеличением номера периода их становится все больше. Если во 2-м периоде металлов всего 2 (литий и бериллий), в 3-м — 3 (натрий, магний, алюминий), то уже в 4-м — 13, а в 7-м — 29.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.

В связи с тем что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
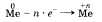
Свойство атомов металлов отдавать электроны является их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
При характеристике физических свойств металлов следует отметить их общие свойства: электрическую проводимость, теплопроводность, металлический блеск, пластичность, которые обусловлены единым видом химической связи — металлической, и металлической кристаллической решетки. Их особенностью является наличие свободно перемещающихся обобществленных электронов между ион-атомами, находящимися в узлах кристаллической решетки.
При характеристике химических свойств важно подтвердить вывод о том, что во всех реакциях металлы проявляют свойства восстановителей, и проиллюстрировать это записью уравнений реакции. Особое внимание следует обратить на взаимодействие металлов с кислотами и растворами солей, при этом необходимо обратиться к ряду напряжений металлов (ряд стандартных электродных потенциалов).
Примеры взаимодействия металлов с простыми веществами (неметаллами):
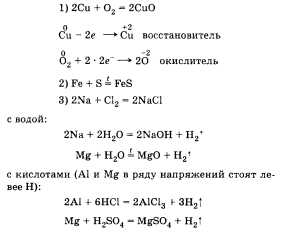
с солями (Zn в ряду напряжений стоит левее Сu): Zn + СuС12 = ZnCl2 + Сu!
Таким образом, несмотря на большое многообразие металлов, все они обладают общими физическими и химическими свойствами, что объясняется сходством в строении атомов и строении простых веществ.
3. Задача. Какой объем и количество вещества азота (моль) израсходуется при взаимодействии с водородом объемом 672 л?

Ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается способность принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.

Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением способности ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. Приведем примеры.

Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями). Следующие уравнения учащийся приводит по желанию:

5. Задача. Определите, какое количество вещества водорода получится, если в реакцию вступили натрий и вода массой 3,6 г?

6. Виды химической связи: ковалентная (полярная и неполярная), ионная, их сходство и различие.
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.
При ответе на данный вопрос следует подробно остановиться на характеристике ковалентной и ионной связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода:  (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
 Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд 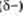 , а на атоме водорода — частичный положительный
, а на атоме водорода — частичный положительный 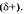 . Таким образом, молекула становится полярной:
. Таким образом, молекула становится полярной: 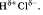
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или
отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные
частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалентная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалентная полярная. В случае, если электроны, участвующие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
Все вышеперечисленные отличия в механизме образования связи объясняют различие в свойствах веществ с разными видами связей.
Все вещества по их поведению в растворах принято условно делить на две группы: а) электролиты и б) неэлектролиты.
Электролитами называют сложные вещества, растворы и расплавы которых способны проводить электрический ток. Неэлектролиты, наоборот, электрический ток не проводят.
К электролитам относят большинство неорганических кислот, щелочей и солей.
Электролиты — хлороводородная (соляная) кислота НС1, хлорид натрия NaCl, гидроксид калия КОН.
К неэлектролитам относят многие органические соединения, например спирты, углеводы (сахара), а также газообразные вещества и оксиды.
В химии диссоциацией принято называть распад кристаллов и молекул на ионы, который приводит к электрической проводимости растворов. Следовательно, причиной электрической проводимости растворов и расплавов некоторых веществ является образование носителей электричества — свободных заряженных частиц, называемых ионами.
Диссоциация происходит под действием молекул растворителя (чаще воды) или температуры. При этом химические связи между частицами в кристаллической решетке разрушаются.
Типичными видами связи для электролитов являются ионная или ковалентная полярная.
Таким образом, под электролитической диссоциацией понимают процесс распада электролитов на ионы под действием молекул воды или при расплавлении.
Рассмотрим электролитическую диссоциацию хлорида натрия (NaCl). При расплавлении энергия, подводимая к кристаллам, усиливает колебания ионов в узлах кристаллической решетки, в результате чего связи между ионами разрушаются и появляются свободные ионы. Аналогичный эффект достигается при растворении хлорида натрия в воде. Только роль разрушающего фактора выполняют молекулы воды, которые как бы растягивают кристалл на отдельные частицы. Но при этом ионы оказываются окруженными («гидратированными») молекулами воды.
Уравнение диссоциации: 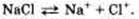
Диссоциация веществ с ковалентной полярной связью происходит несколько сложнее, например диссоциация хлороводорода в воде. Сначала происходит взаимодействие молекул воды с молекулами НС1, находящимися в узлах кристаллической решетки, и их отщепление от нее, а затем происходит «растягивание» полярной молекулы НС1 на гидра-
тированные ионы 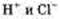 . Уравнение электролитической диссоциации хлороводорода выглядит так:
. Уравнение электролитической диссоциации хлороводорода выглядит так: 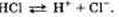 . В составе кислот, солей и оснований (щелочей) можно выделить части, определяющие их химические свойства. У кислот это ионы водорода, у солей — ионы металлов и кислотных остатков, у щелочей — ионы гидроксогрупп.
. В составе кислот, солей и оснований (щелочей) можно выделить части, определяющие их химические свойства. У кислот это ионы водорода, у солей — ионы металлов и кислотных остатков, у щелочей — ионы гидроксогрупп.
а) Кислоты диссоциируют на катионы водорода (упрощенно) и анионы кислотных остатков:
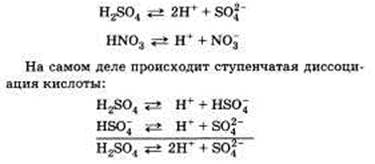

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 4375; Нарушение авторских прав?; Мы поможем в написании вашей работы!