
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Ла Шательє. Вплив температури, тиску та концентрації реагуючих речовин на зміщення хімічної рівноваги. Пояснити на прикладах
|
|
|
|
принцип Ле Шательє, розглянемо просту хімічну реакцію. Два речовини (реактиви) взаємодіють один з одним, в результаті взаємодії утворюють третю речовина (продукт), яке прагне до розщеплення на вихідні речовини. Це можна зобразити в вигляді наступного рівняння:
A + B <---> C
Подвійна стрілка позначає оборотну реакцію. При протіканні прямої реакції зліва направо відбувається утворення речовини C з речовин A і B. У разі зворотної реакції (справа наліво) речовина C розщеплюється на речовини A і B. Коли ця система знаходиться в хімічному рівновазі, швидкості прямої і зворотної реакцій однакові - в одній точці даної системи утворюється молекула речовини C, а десь в іншому місці інша молекула речовини С розпадається.
ДіЮ принципу Ле Шательє можна простежити на прикладі зміни хімічного складу дощу або розчинення шипучою антацидний (знижує кислотність шлункового соку) таблетки у воді. В обох випадках в хімічній реакції беруть участь вуглекислий газ (CO2), вода (H2O) і вугільна кислота (H2CO3):
CO2 + H2O <-> H2CO3
Коли дощова крапля потрапляє в повітря, вона поглинає вуглекислий газ, і концентрація в лівій частині реакції зростає. Для підтримки рівноваги утворюється більша кількість вугільної кислоти. В результаті дощ стає кислотним (див. Кислотний дощ). Додавання вуглекислого газу зміщує рівновагу реакції вправо. Протилежна реакція відбувається при опусканні у воду таблетки антациду (речовини, нейтралізуючого кислоту). Бікарбонат натрію (антацид) вступає в реакцію з водою, і утворюється вугільна кислота, що призводить до збільшення концентрації речовини в правій частині реакції. Щоб відновилося рівновагу, вугільна кислота розкладається на воду і вуглекислий газ, який ми й спостерігаємо у вигляді бульбашок.
|
|
|
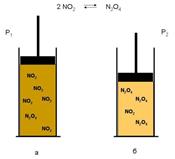 Наведемо приклад реакції, в якій важливим для положення рівноваги фактором є тиск. Вона теж відбувається в газовій фазі:
Наведемо приклад реакції, в якій важливим для положення рівноваги фактором є тиск. Вона теж відбувається в газовій фазі:
2 NO2 (г) N2O4 (г)
При кімнатній температурі NO2 - темно-коричневий газ (часто його називають «бурим» газом). Продукт його димеризації N2O4 безбарвний. Обидва газу при звичайних умовах присутні в суміші, тобто знаходяться в хімічному рівновазі. Якщо збільшувати у такий рівноважної хімічної системі тиск, то рівновага зсувається вправо - у бік утворення N2O4. Справа в тому, що при одночасному збільшенні концентрації [NO2] і [N2O4] перевагу отримує пряма реакція. В її кінетичне рівняння концентрація [NO2] входить в квадраті:
Vпр = k1 [NO2] 2; Vобр = k2 [N2O4]
Що відбувається при цьому зрушення рівноваги вправо можна спостерігати експериментально: при стисканні суміші газів вона світлішає, оскільки зменшується концентрація пофарбованого NO2 і зростає концентрація безбарвного N2O4 (рис
При збільшенні тиску (Р2> Р1) загальна кількість молекул в рівноважної суміші зменшується - система «пручається» підвищення тиску: а) в системі більше молекул NO2 (суміш інтенсивно забарвлена), б) після збільшення тиску молекул NO2 стає менше (забарвлення слабшає).
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1335; Нарушение авторских прав?; Мы поможем в написании вашей работы!