
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімія сполук карбону. Оксиди карбону, карбонатна кислота: добування та властивості. Біологічна роль карбону
Гідрування органічних сполук
Взаємодія із лужними та лужноземельними металами
Взаємодія з неметалами
Найактивніше реагує з галогенами утворює галогеноводні:
F2 + H2 = 2HF, реакція протікає із вибухом за будь-якої температури,
Cl2 + H2 = 2HCl, реакція протікає тільки на світлі.
При підпалюванні чи в присутності платинового каталізатора водень реагує із киснем
O2 + 2H2 = 2H2O, реакція протікає із вибухом.
Суміш двох об'ємів водню та одного об'єму кисню називається гримучим газом.
При нагріванні водень зворотно взаємодіє із сіркою:
S + H2 ⇔ H2S (сірководень)
З азотом — при нагріванні, підвищенні тиску та у присутності каталізатору (залізо):
N2 + 3H2 = 2NH3 (аміак)
Із сажею водень взаємодіє при сильному нагріванні:
C + 2H2 = CH4 (метан)
Водень утворює із активними металами гідриди:
2Na + H2 = 2NaH (гідрид натрію)
Ca + H2 = CaH2 (гідрид кальцію)
Взаємодія із оксидами металів (як правило, d-елементів)
Оксид відновлюються до металів:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Взаємодія із оксидами неметалів (як правило, оксидами азоту та вуглецю)
Водень є компонентом синтез-газу при отриманні метилового спирту:
CO + 2 H2 → CH3ОН;
При дії водню на ненасичені вуглеводні у присутності нікелевого каталізатора та при підвищеній температурі, відбувається реакція гідрування:
CH2=CH2 (етилен) + H2 = CH3-CH3 (етан)
Водень відновлює альдегіди до спиртів:
CH3CHO (оцтовий альдегід) + H2 = C2H5OH (етанол)
Перексид водню, Н2О2 — нестійка хімічна сполука, яка здатна спонтанно розпадатися із виділенням кисню та утворенням води (2Н2О2 → 2Н2О + O2). У біологічних системах є токсичною, оскільки може спричиняти утворення вільних радикалів. Детоксикується з допомогою ферментів антиоксидативного захисту у цитоплазмі клітини, та деяких органелах, зокрема мітохондріях та пероксисомах.
Сполуки карбону. Органі́чні сполу́ки — клас сполук, в склад яких входить Карбон (за винятком карбідів, карбонатної кислоти, карбонатів, оксидів Карбону і ціанідів). Це його біологічна роль. Окрім Карбону, вони майже завжди містять Гідроген, досить часто — Оксиген, Нітроген та галогени, рідше Фосфор, Сульфур та інші елементи. В органічних сполуках Карбон завжди виявляє валентність IV.
С  — карбон(IV) оксид (вуглекислий газ).
— карбон(IV) оксид (вуглекислий газ).
CO — карбон(II) оксид (чадний газ).
Карбону оксиди мають молекулярні кристалічні ґратки.
2) Із силіцій оксидів найбільш розповсюджений 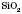 — силіцій діоксид (силіцій (IV) оксид, кремнезем, пісок, кварц). Він має атомні кристалічні ґратки.
— силіцій діоксид (силіцій (IV) оксид, кремнезем, пісок, кварц). Він має атомні кристалічні ґратки.
Фізичні властивості карбон і силіцій оксидів. Карбон(IV) оксид (вуглекислий газ) — газ без кольору, смаку і запаху, важчий за повітря, добре розчиняється у воді, реагуючи з нею, легко скраплюється при кімнатній температурі й тиску 5 МПа. Твердий вуглекислий газ називають «сухим льодом».
Карбон(IІ) оксид (чадний газ) — газ без кольору і запаху. Погано розчиняється у воді, скраплюється при атмосферному тиску і температурі 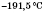 . Надзвичайно отруйний, викликає ядуху.
. Надзвичайно отруйний, викликає ядуху.
Карбонатна кислота -слабка двоосновна кислота з хімічною формулою 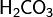 . У чистому вигляді нестійка. Утворюється в малих кількостях при розчиненні вуглекислого газу у воді, в тому числі і вуглекислого газу з повітря. Утворює ряд стійких неорганічних та органічних похідних: солі (хімія) (карбонати та гідрокарбонати), естери, аміди та ін..
. У чистому вигляді нестійка. Утворюється в малих кількостях при розчиненні вуглекислого газу у воді, в тому числі і вуглекислого газу з повітря. Утворює ряд стійких неорганічних та органічних похідних: солі (хімія) (карбонати та гідрокарбонати), естери, аміди та ін..
Карбонатна кислота утворюється при розчиненні у воді діоксиду вуглецю:

Вміст вугільної кислоти в розчині збільшується при зниженні температури розчину та збільшенні тиску вуглекислого газу.
Також вугільна кислота утворюється при взаємодії її солей (карбонатів та гідрокарбонатів) з більш сильною кислотою. При цьому велика частина утворилася вугільної кислоти, як правило, розкладається на воду і діоксид вуглецю:
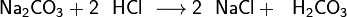
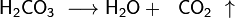
|
|
Дата добавления: 2015-05-23; Просмотров: 1833; Нарушение авторских прав?; Мы поможем в написании вашей работы!