
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типи молекул
Типи гібридизації
sр-Гібридизація. Одна s-АО та одна р-АО утворюють дві гібридні АО. Дві гібридні електронні хмари розташовані у просторі під кутом 180
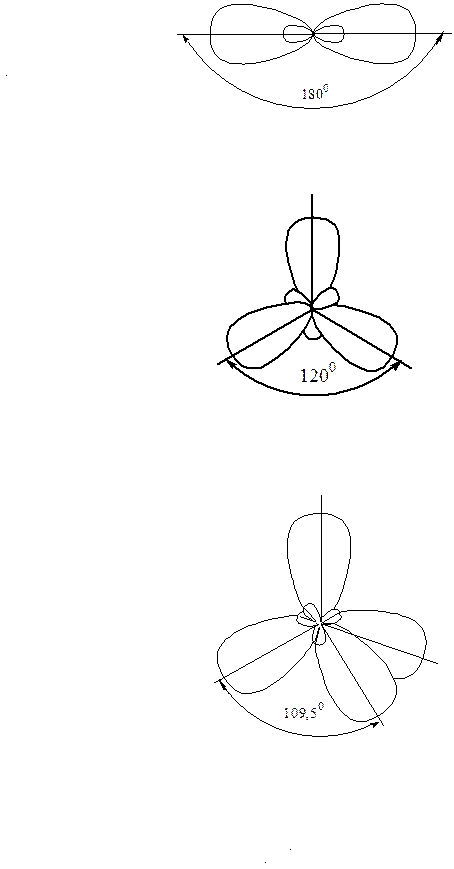
sр2-Гібридизація. Одна s-АО та дві р-АО утворюють три гібридні АО. Три гібридні електронні хмари розташовані у просторі під кутом 1200:
sр3-Гібридизація. Одна s-АО та три р-АО утворюють чотири гібридні АО. Чотири гібридні електронні хмари орієнтовані у просторі від центра тетраедра до його вершин, тобто під кутами ~ 1090:
Залежно від просторового положення зв’язків у молекулах та їх полярності розрізняють неполярні та полярні молекули.
В неполярних молекулах центри позитивних та негативних зарядів збігаються:

Полярні молекули є диполями, тобто системами, в яких центри позитивних та негативних зарядів розміщені на деякій відстані один від одного:
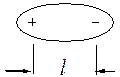
Слід розрізняти полярність зв`язку і полярність молекули. Для двохатомних молекул ці поняття збігаються. Якщо зв`язок між двома атомами такої молекули є неполярним, то і молекула теж неполярна. В свою чергу молекула є полярною, якщо між двома атомами, з яких складається молекула, існує полярний зв`язок.
Багатоатомна молекула, як і двохатомна, теж є неполярною, якщо зв`язок між атомами є неполрним. Але у багатоаомних молекулах зв`язок між атомами може бути полярним, а самі молекули залежно від просторової будови можуть бути як полярними, так і неполярними.
Приклад 1. Складіть електронні конфігурації атомів та наведіть схеми перекривання електронних хмар атомів в молекулах:
а) B Cl3; б) H2 Sе; в) H2 O.
Вкажіть тип хімічного зв’язку між атомами. У випадку гібридизації АО вкажіть її тип. Полярними чи неполярними є молекули?
Розв’язання.
Складаємо електронні конфігурації центральних атомів, що підкреслені, та оточуючих їх атомів елементів в наведених в умові молекулах.
а) В 1s22s22p1
Cl 1s22s22p63s23p2xp2yp1z
Атом бору у нормальному стані містить один неспарений електрон, тобто є одновалентним. А в молекулі BCl3 валентність бору становить ІІІ, отже, його атом в молекулі знаходиться у збудженому стані: В* 1s22s12p1хр1уpz.
За числом зв’язуючих АО, тобто АО з неспареними електронами, які розташовані на різних підрівнях (одна АО на s-підрівні та дві АО на р-підрівні), визначаємо тип гібридизації: sp2-гібридизація.
Внаслідок перекривання трьох гібридних електронних хмар атома бору, розміщених у площині під кутом 1200, з р-електронними хмарами неспарених електронів трьох атомів хлору утворюється молекула BCl3, що має форму трикутника:
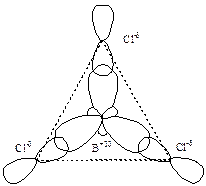
Різниця електронегативностей бору та хлору становить:
Dχ = χ(Cl) – χ (В) = 3,0-2,0 = 1; Dχ<2.
Отже, між атомом бору та атомами хлору виникає ковалентний полярний зв’язок. Спільні електронні пари зміщуються до атомів більш електронегативного елемента, тобто до атомів хлору, На атомах хлору виникає негативний ефективний заряд „-δ”, а на атомі бору – позитивний „+3δ”. Молекула BCl3 є неполярною, тому що центри позитивних та негативних зарядів збігаються у центрі трикутника.
б) Se 1s22s22p63s23р63d104s24p2xp1yp1z
Н 1s1
Атом селену в молекулі H2Sе знаходиться у нормальному стані, тому що число неспарених електронів в атомі (два) відповідає валентності селену в сполуці. Оскільки зв’язуючі АО селену, тобто АО з неспареними електронами, розміщені на одному і тому ж підрівні (р-підрівні), то гібридизація АО не відбувається. В утворенні зв’язків з атомами гідрогену беруть участь дві р-електронні хмари атома селену, розташовані у просторі вздовж координатних осей під кутом 900. Отже, молекула H2Sе є кутовою.
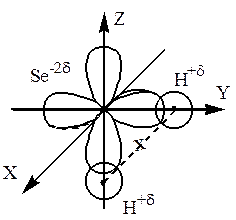
Між атомом селену та атомами гідрогену виникає ковалентний полярний зв’язок: Dχ = χ(Se) – χ(Н) = 2,4 – 2,1 = 0,3, Dχ<2. Оскільки спільні електронні пари зміщені до атома селену, то на атомі селену виникає негативний ефективний заряд „-2δ”, а на атомах гідрогену – позитивний „+δ”.
 Молекула H2Sе є полярною, тому що центри позитивних та негативних зарядів розміщені на певній відстані один від одного: центр негативних зарядів знаходиться у центрі координатних осей, а центр позитивних – посередині лінії, яка зв’язує ядра атомів гідрогену (на малюнку позначений хрестиком).
Молекула H2Sе є полярною, тому що центри позитивних та негативних зарядів розміщені на певній відстані один від одного: центр негативних зарядів знаходиться у центрі координатних осей, а центр позитивних – посередині лінії, яка зв’язує ядра атомів гідрогену (на малюнку позначений хрестиком).
в) О 1s22s22p2xp1yp1z
Н 1s 1
В атомі оксигену, на відміну від атома селену, відбувається sp3-гібридизація АО: дві незв’язуючі АО, тобто АО зі спареними електронами (2s2- та 2р2х-АО) та дві зв’язуючі АО, тобто АО з неспареними електронами (2p↑y та 2p↑z-АО), при змішуванні утворюють чотири гібридні АО. Але в утворенні зв’язку беруть участь тільки дві зв’язуючі АО. Внаслідок перекривання двох гібридних електронних хмар атома оксигену з s-електронними хмарами атомів гідрогену утворюється кутова молекула.
Гібридизацією АО пояснюється те, що валентний кут між зв’язками у молекулі Н2О близький до тетраедричного (104,50) на відміну від валентного кута в молекулі H2Sе (910).
Зв’язок між атомом оксигену та атомами гідрогену також є ковалентним полярним, тому що різниця електронегативностей оксигену та гідрогену становить: Dχ = χ(О) – χ(Н) = 3,5 – 2,1 = 1,4; тобто Dχ < 2.
Більш електронегативним елементом є оксиген, тому на його атомі виникає негативний ефективний заряд „-2δ”, а на атомах гідрогену – позитивний „+δ”.
Молекула Н2О за таких же причин, що і молекула H2Sе, є полярною.
|
|
Дата добавления: 2015-05-23; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!