
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість хімічних реакцій в гомогенних та гетерогенних системах
|
|
|
|
Хімічна кінетика і хімічна рівновага.
Хімічні реакції відбуваються з різними швидкостями. Існують вибухові реакції, швидко відбуваються реакції в розчинах електролітів. Органічні речовини, навпаки, реагують між собою дуже повільно. Є дуже багато реакцій, швидкість яких настільки мала, що з нею можна не рахуватись. Наприклад, взаємодія кисню з воднем при звичайній температурі.
Вчення про швидкість і механізм хімічних реакцій називається хімічною кінетикою. Воно має дуже велике практичне і теоретичне значення. Від швидкості реакції в різних технологічних процесах залежить продуктивність апаратури, перебіг тих або інших біологічних процесів, ефективність дії на живий організм різних лікарських препаратів.
Щоб одержати в одиницю часу максимальний вихід продукту, необхідно максимально збільшити швидкість реакцій, що лежать в основі того чи іншого хімічного процесу. З іншого боку, небажані процеси, наприклад корозію металів, необхідно як можна більше сповільнити. Саме тому вивчення законів хімічної кінетики, які відкривають шлях до свідомого регулювання швидкостей реакцій, має надзвичайно важливе значення для практики.
Управління хімічними процесами є головним завданням хімічної кінетики.
Розглянемо перебіг хімічної реакції і її швидкість в гомогенній і гетерогенній системах.
Якщо реакція відбувається в гомогенній системі, то вона проходить в усьому об'ємі системи. Наприклад,

Якщо реакція відбувається між речовинами, які утворюють гетерогенну систему, то вона може проходити тільки на поверхні поділу фаз.
Такі реакції дуже поширені в природі і в різних галузях виробництва. Можна навести багато прикладів гетерогенних реакцій, які мають велике значення в сільськогосподарському виробництві, наприклад, процеси, які відбуваються в грунті з добривами та хімічними меліорантами, розчинення газів в грунтовому розчині тощо.
|
|
|
Визначальною ознакою всіх гетерогенних процесів є їх складність та багатостадійність. Будь-яка гетерогенна реакція складається найменшою мірою з трьох стадій. Перша стадія – це перенос реагуючих речовин до поверхні поділу фаз, тобто до зони реакції. Другою стадією є сама хімічна реакція. Третя стадія полягає у відведенні продуктів реакції з зони, де ця реакція відбувається.
Отже, швидкість будь-якої гетерогенної реакції складається з швидкості самої реакції і швидкостей підведення реагуючих речовин до межі поділу фаз і відведення їх від неї, головним чином, шляхом дифузії.
Оскільки в гетерогенних процесах взаємодія відбувається на поверхні поділу фаз, то для таких процесів велике значення має площа поверхні фаз, яка залежить від ступеня подрібнення реагуючих речовин. Окрім того, швидкість цих реакцій залежить від швидкості дифузії, тобто від швидкості, з якою молекули газу або розчиненої речовини надходять до зони реакції.
Наочним прикладом гетерогенної реакції може бути розчинення металів в кислотах:
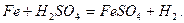
Швидкістю гомогенної реакції називають кількість речовини, що вступила в реакцію або утворилася в результаті реакції за одиницю часу в одиниці об'єму системи:
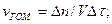
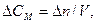 тоді
тоді 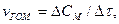
n - кількість речовини; СМ - молярна концентрація; V - об'єм систе-ми; ∆τ - проміжок часу.
Швидкістю гетерогенної реакції називають кількість речовини, що вступила в реакцію або утворилася в результаті реакції за одиницю часу на одиниці площі поверхні фази:

де S - площа поверхні фази.
До важливих чинників, які впливають на швидкість реакції, належать такі: природа реагуючих речовин, їх концентрація, температура, присутність каталізаторів.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1510; Нарушение авторских прав?; Мы поможем в написании вашей работы!