
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метил-3-етилоктан
Отримання
Промислові методи
1. Крекінг алканів нафти
Лабораторні методи
1. Дегідратація спиртів
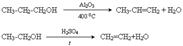
2. Відщеплення галогенів (Cl, Br)
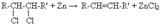
3. Гідрування алкінів
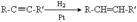
Хімічні властивості
1. Реакція гідрування
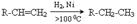
2.Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі)
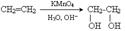
Реакції приєднання HBr і HCl
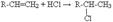
5. Реакції приєднання Br2 і Cl2
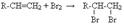
6. Реакції приєднання води (за правилом Марковникова)
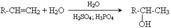
7. Реакції полімеризації

4. етил ацетилен=метилелтикетон=бутан-2-ол=втор. бутиловий естер оцтової к-ти
1. CHΞC-CH2-CH3 + HOH→CH3-CH2-C(=O)-CH3
2. CH3-CH2-C(=O)-CH3+ H2→ CH3-CH2-CH(OH)-CH3
3. CH3-CH2-CH(OH)-CH3 + CH3-COOH→CH3C=O-O-CH(CH3)-CH2-CH3 + H2O
CH3-CH2-C(CH3)(CH2-CH3)-(CH2)5-CH3
Бромитий ізобутил BrH2C-CH(CH3)2
6. Одержання та власт. ароматичних вуглеводнів.
Промислові методи отримання бензолу і його гомологів
1. перегонка кам'яновугільної смоли
2. каталітичний риформінг нафти
3. реакція Реппе
3CHΞCH→C6H6
Лабораторні методи
1. дегідрогенізація циклогексану

2. дегідроциклізація гептану
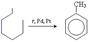
Хімічні властивості бензену
1. реакції приєднання
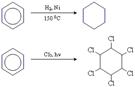
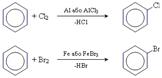
2. реакції заміщення
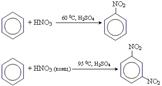
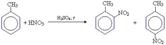
• реакція нітрування
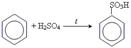
• реакція сульфування
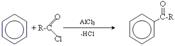
• реакція Фриделя-Крафса
•• алкілювання
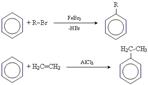
•• ацилювання
• реакції галогенування (Cl, Br)
• реакція нітрування толуену
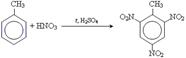 .
.
7. етилен = етанол = оцтова к-та = моно хлороцтова к-та = ізопропіловий естер моно хлороцтова к-ти
1.CH2=CH2 + HOH→CH3-CH2-OH
2. CH3-CH2-OH + [O]→CH3-COH+ [O]→ CH3-COOH
3. CH3-COOH + CL2→ CH2(CL)-COOH + HCL
4. CH2(CL)-COOH + CH(CH3)2-OH→
CH2(CL)-C=O-O-CH(CH3)2 + H2O
8. 2,4-диметил-4-етилоктан
CH3-CH(CH3)-CH2-C(CH2)(CH2-CH3)-(CH2)4-CH3
Трет. бутиловий спирт H3C-C(CH3)2-OH
9. Отримання і хімічні властивості альдегідів
Альдегіди і кетони значно поширені у природі. Значна кількість карбонільних сполук біологічного походження входить до складу ефірних масел*. Як приклад можна навести цитраль* і н -деканаль*, що входять до складу апельсинового і лимонного масел або ментон, що входить до складу м'ятного масла*.
Використання:
• органічний синтез
• виробництво полімерних матеріалів
• виробництво лікарських препаратів і дезінфікуючих засобів
• виготовлення
• виробництво барвників
Отримання
1. окислення первинних спиртів
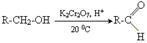
2. каталітична дегідрогенізація первинних спиртів
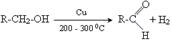
Отримання оцтового альдегіду
1. каталітичне окислення етилену

2. отримання за реакцією Кучерова
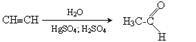
Отримання і хімічні властивості кетонів
Отримання
1. окислення вторинних спиртів
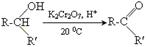
2. отримання за реакцією Кучерова
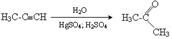
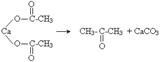
3. піроліз кальцієвих солей карбонових кислот
10. пропілен = 3-хлорпроп-1-ен = аліловий спирт = 1,2-дихлорпропан-3-ол = гліцерин
1. CH2=CH-CH3 + →
2. CH2=CH-CH2CL + NaOH→ CH2=CH-CH2-OH +NaCL
3. CH2=CH-CH2-OH + CL2→ CH2CL-CHCL-CH2-OH + H2
4. CH2CL-CHCL-CH2-OH + 2NaOH→CH2OH-CHOH-CH2OH + NaCL
11. 2,4,6 триметилнонан
CH3-CH(CH3)-CH2-CH(CH3)- CH2-CH(CH3)-CH2-CH3
Пропіоновий альдегід CH3-CH2-COH
12.Реакції альдегідів та кетонів.
Хімічні властивості альдегідів
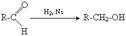
1. приєднання водню
2. реакції окислення
• окислення біхроматом калію
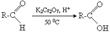
• реакція срібного дзеркала
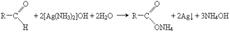
• реакція окислення гідроксидом Купруму(ІІ)
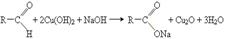
Хімічні властивості кетонів
1. приєднання водню
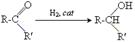
2. реакції окислення для кетонів протікають лише під дією дуже сильних окислювачів і супроводжуються розривом вуглецевого ланцюга. кетони не дають реакцію срібного дзеркала і не окислюються гідроксидом Купруму(ІІ).
13. кальцій карбід = ацетилен = бензин = етилбеензен = вінілбензен = полістирол
1.СаС2 + 2H2O→CHΞCH + Ca(OH)2
2. 3CHΞCH→C6H6
3. C6H6 + CH2=CH2→ C6H5-CH2-CH3
4. C6H5-CH2-CH3→ C6H5-CH=CH2 + H2
5. …C6H5-CH=CH2 + C6H5-CH=CH2 + C6H5-CH=CH2 …→…CH2-CH(C6H5)- CH2-CH(C6H5)- CH2-CH(C6H5)-CH2…
14. 2,3,3-триметилгексан CH3-CH(CH3)-C(CH3)2-(CH2)2-CH3
Масляна к-та CH3-CH2- CH2-CООН
15.Гідроксикислоти.Одержання, власт,оптична ізомерія
Оптичні ізомери також відносять до стереоізомерів. Але на відміну від цис- транс-ізомерів, температури топлення й кипіння, густина та інші властивості оптичних ізомерів однакові. Вони відрізняються лише активністю відносно плоскополяризованого світла. Здатність обертати площину поляризаціїполяризованного світла була названа оптичною активністю, а самі речовини - оптично активними. Явище оптичної активності поширене серед органічних речовин природного походження (оксикислоти, амінокислоти, вуглеводи, білки, нуклеїнові кислоти). Це явище має велике біологічне значення, оскільки пов’язане з асиметрією речовин, що входять до складу живих організмів. Оптично активні речовини існують у вигляді оптичних ізомерів: правих (+)-форм (конфігурацій) і лівих (-)-форм (конфігурацій), тобто у вигляді стереоізомерів, які відрізняються різним розміщенням лігандів у просторі навколо асиметричного атома С*.
Атом вуглецю з чотирма різними замісниками (лігандами) називають асиметричним (позначається зірочкою С*).
16. ацетилен = бензин = ізопропілбензен = бензойна к-та = мета-нітробензойна к-та = хлорангідрид мета-нітробензойної к-ти
1. 3CHΞCH→C6H6
2. C6H6 + CH(CH3)=CH2→ C6H5-CH(CH3)-CH3
3. C6H5-CH(CH3)-CH3 + O2→ C6H5COOH + CH3-CH3
4. C6H5COOH + HNO3→ C6H4(NO2)COOH + HOH
5. C6H4(NO2)COOH + PCL5 → C6H4(NO2)COCL + POCL3 + HCL
17. 2-метил-бут-2-ен СН3-С(СН3)=СН-СН3
Етаналь СН3-СОН
18.Жири, їх будова, класифікація та властивості.
Жири - органічні речовини, які являють собою складні ефіри гліцерину і вищих карбонових кислот. Жири надзвичайно поширені у живій природі і входять до складу всіх тваринних і рослинних клітин. Жири виконують функцію джерела енергії і у деяких тварин також функцію терморегуляції.
Жири мають високу енергетичну цінність і тому є необхідною складовою харчування людини.
Класифікація
• класифікація за природним походженням
рослинні жири (рослинні масла)
тваринні жири
Отримання і хімічні властивості жирів
Отримання
Жири отримують з продуктів рослинного або тваринного походження.
Хімічні властивості
1. Гідроліз (омилення) жирів у лужному середовищі

19. ацетилен = бензен = ізопропілбензен = фенол = натрій фенолят = дифенілів етер
1. 3CHΞCH→C6H6
2. C6H6 + CH(CH3)=CH2→ C6H5-CH(CH3)-CH3
3. C6H5-CH(CH3)-CH3 + O2 (+H2SO4)→C6H5OH + CH3-C=O-CH3
4. 2C6H5OH + 2Na → 2C6H5ONa + H2
5. C6H5ONa + 2C6H5I → C6H5-O-H5C6
20. 2,5-диметилгекс-3-ен CH3-CH(CH3)-CH=CH-CH(CH3)-CH3
Валеріанова к-та CH3-(CH2)3-COOH
|
|
Дата добавления: 2015-05-24; Просмотров: 914; Нарушение авторских прав?; Мы поможем в написании вашей работы!