
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Найважливішим поняттям хімічної кінетики є швидкість хімічної реакції, тобто зміна концентрації вихідних речовин або продуктів реакції за одиницю часу:
|
|
|
|
Найважливішим поняттям хімічної кінетики є швидкість хімічної реакції, тобто зміна концентрації вихідних речовин або продуктів реакції за одиницю часу:
V = 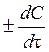 ,
,
а середня швидкість за проміжок часу Dt розраховується як
V» - 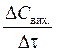 = +
= + 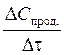 .
.
Швидкість хімічної реакції залежить від концентрації реагуючих речовин згідно з законом діючих мас: у кожний момент часу швидкість реакції пропорційна добутку концентрацій реагуючих речовин, які взято в степенях, рівних стехіометричним коефіцієнтам, що стоять у рівнянні хімічної реакції перед цими речовинами. Наприклад, для процесу взаємодії газоподібних речовин
2SO2 + O2 Û 2SO3; D Н < 0 (для прямої реакції)
швидкості прямої та зворотної реакцій у деякий момент часу будуть дорівнювати:
 =
= 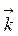 (С (SO2))2 С (O2);
(С (SO2))2 С (O2);
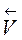 =
= 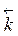 (С (SO3))2,
(С (SO3))2,
де С (Хі) – концентрації речовин, k – коефіцієнт пропорційності – константа швидкості хімічної реакції, тобто швидкість при одиничних молярних концентраціях усіх речовин (1 моль/л).Потрібно вміти розраховувати зміни швидкостей реакцій при зміні концентрацій або змінах тиску й об’єму системи.
Приклад 1. Як зміняться швидкості наведених вище реакцій при збільшенні тиску в два рази?
Розв’язання. При збільшенні тиску в системі вдвічі концентрації всіх газів збільшаться також у два рази, що приведе до збільшення швидкостей обох реакцій:
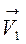 =
= 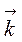 (2 С (SO2))2×(2 С (O2)),
(2 С (SO2))2×(2 С (O2)),  /
/ 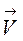 = 8;
= 8;
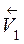 =
= 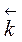 (2 С (SO3))2,
(2 С (SO3))2, 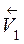 /
/ 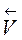 = 4.
= 4.
Таким чином, швидкість прямої реакції зросте у вісім разів, а зворотної – у чотири рази.
Потрібно знати, що для гетерогенних реакцій, які перебігають на поверхні твердих речовин (на відміну від гомогенних, які перебігають в усьому об’ємі), концентрації останніх незмінні і тому відсутні у виразах швидкостей, тому що кількість реагуючих частинок на одиницю площі поверхні не змінюється у ході реакції.
|
|
|
Залежність швидкості реакції від температури можна описати простим наближеним правилом Вант-Гоффа:
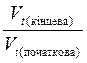 = g
= g  ,
,
де g - температурний коефіцієнт реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури на кожні 10°.
Приклад 2. Для якоїсь реакції g =3, а зміна температури D t = 30 °С. Як зміниться при цьому швидкість реакції?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 303; Нарушение авторских прав?; Мы поможем в написании вашей работы!