
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Після вивчення цієї теми треба вміти розраховувати значення різних типів концентрації розчиненої речовини
|
|
|
|
Після вивчення цієї теми треба вміти розраховувати значення різних типів концентрації розчиненої речовини, знати їх взаємозв’язок. Найбільш поширеними є такі типи (тобто способи вираження) концентрацій розчинів:
1. Масова частка, w(х) - відношення маси розчиненої речовини (Х) до маси розчину:
w(Х)= 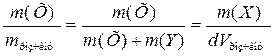 ,
,
де m (Х) і m (Y) – маси розчиненої речовини та розчинника відповідно, d - густина розчину, г /л.
2. Молярна частка, χ(Х) - відношення кількості (у молях) розчиненої речовини до загальної кількості всіх компонентів розчину:
χ (x) = 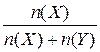 .
.
Обидві величини при помноженні на 100 дають ці ж самі характеристики у відсотках.
3. Молярна концентрація, С (Х) - відношення кількості розчиненої речовини до об’єму розчину:
C (Х) = 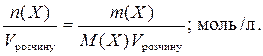
4. Масова концентрація, ρ (Х) - відношення маси розчиненої речовини до об’єму розчину:
ρ (Х) = 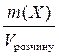 ; г/л або г/мл.
; г/л або г/мл.
5. Моляльність розчину, Сm (X) - відношення кількості розчиненої речовини до маси розчинника в к г:
Сm (X) = 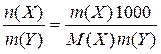 ; моль/к г.
; моль/к г.
У цю формулу m (Y) підставляється у грамах.
6. Густина розчину (пов’язана з концентрацією):
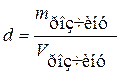 ; г/л або г/мл.
; г/л або г/мл.
З усіх добре відомих законів про загальні властивості розчинів насамперед потрібно знати другий закон Рауля, згідно з яким підвищення температури кипіння та зниження температури замерзання пропорційні моляльності розчину:
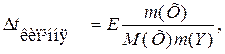
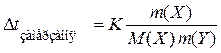 ,
,
де Е – ебуліоскопічна, K – кріоскопічна сталі розчинника.
Приклад 1. Розрахуйте: а) молярну частку гідроксиду калію в розчині; б) молярну концентрацію розчину, якщо 500 мл розчину містять 308 г KОН (густина розчину дорівнює 1,50 г /мл).
Розв’язання: а) 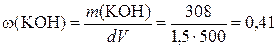 або 41%;
або 41%;
б) C (KOH) = 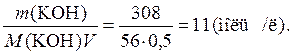
Приклад 2. Температура кипіння чистого сірковуглецю дорівнює 46,3 °С. Розрахуйте температуру кипіння розчину 1,22 г бензойної кислоти (С6Н5СООН) у 100 г сірковуглецю, якщо Е (СS2) = 2,30 К × к г /моль.
|
|
|
Розв’язання. Згідно з другим законом Рауля
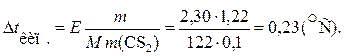
Температура кипіння розчину буде більшою, ніж у чистого розчинника:
t 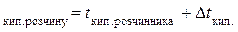 = 46,3 + 0,23 = 46,53 (°С).
= 46,3 + 0,23 = 46,53 (°С).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 287; Нарушение авторских прав?; Мы поможем в написании вашей работы!