
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виконання реакції. Дія загальних реагентів
|
|
|
|
Дія загальних реагентів
Виконання реакції
а) до 2-3 крапель розчинів солей Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, [SbCl6]3- та [SbCl6]- (в окремих пробірках) додати по 1-2 краплини 2М розчинy NаОН (у випадку [SbCl6 ]3- та [SbCl6 ]- додати по 3-4 краплини NаОН). Осади відділити центрифугуванням і перевірити розчинність одержаних гідроксидів у кислотах і лугах;
б) до 2-3 крапель розчинів солей заліза (II), мангану (IІ), стибію(ІІІ), (кожен в окремій пробірці) додати при перемішуванні 1-2 краплі розчину гідроксиду натрію (до лужної реакції середовища) і 2-3 краплі 3%-ного розчину пероксиду водню. Осади відділити центрифугуванням і розчинити:
• Fe(OH)3 – у декількох краплях 2М нітратної кислоти;
• гідроксид мангану (IV) MnO(OH)2 – в 0,5 мл розведеної сульфатної кислоти і 2-3 краплях пероксиду водню (3%-ний розчин) при нагріванні;
• гідроксид стибію (V) – у декількох краплях розчину HCl і надлишку 2М розчинy NаОН.
5.1.2.1. Реакція з розчином NH3. При дії концентрованого розчину амоніаку на розчини катіонів V аналітичної групи також утворюються осади гідроксидів:
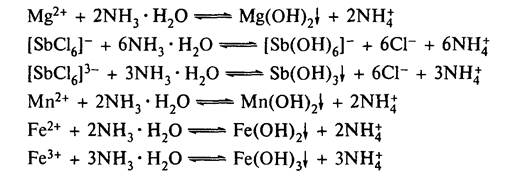
Гідроксиди не утворюють розчинних координаційних сполук з амоніаком, їх осади не розчиняються в надлишку NH4OH.
Mn(OH)2, Mg(OH)2 та Fe(OH)2 розчиняються в амонійних солях (NH4Cl, NH4NO3), тому з водних розчинів їх солей осаджуються розчином NН4ОН не повністю.
а) до 2-3 крапель розчинів солей Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, [SbCl6]3- та [SbCl6]- (в окремих пробірках) додати рівний об’єм 2М розчинy NН4ОН. Осади відділити центрифугуванням і при перемішуванні додати надлишок розчину NН4ОН;
б) до 2-3 крапель розчинів солей заліза (II), марганцю (IІ), мангану(ІІ), (кожен в окремій пробірці) додати 4-5 крапель насиченого розчину NН4Cl, а потім 2-3 краплі 2М розчинy NН4ОН, перемішати.
Записати отримані ефекти.
|
|
|
5.1.2.2. Натрій карбонат Na2CO3 утворює з усіма катіонами аморфні осади білого кольору, за винятком Fe3+. Білий осад карбонату Fe2+. FeCO3 зразу окиснюється на повітрі до червоно-бурого осаду основної солі Fe(OH)CO3.
Sb(III) та Sb(V) утворюють осади HSbO2 та HSbO3 відповідно. Mg2+ утворює білий осад основної солі Mg2(OH)2CO3, розчинної в мінеральних кислотах і солях амонію, тоді як HSbO2, HSbO3, Ві(ОН)СО3 і MnСО3 розчиняються. лише в мінеральних кислотах.
Ця властивість Mg2(OH)2CO3 дозволяє відокремлювати Mg2+-катіон від решти катіонів V аналітичної групи.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!