
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виконання реакції. До 2 крапель розчину солі магнію додати краплю розчину NН4Сl, 2 краплі спиртового розчину 8-оксихіноліну (5%-го) і 2 краплі 2М розчинуNН4ОН
Виконання реакції
Виконання реакції
До 2 крапель розчину солі магнію додати краплю розчину NН4Сl, 2 краплі спиртового розчину 8-оксихіноліну (5%-го) і 2 краплі 2М розчинуNН4ОН.
5.1.4. Характерні реакції на катіони Fe2+
Із загальноаналітичних реакцій характерними є реакції комплексоутворення та специфічні реакції окиснення ферум(ІІ)-катіона.
5.1.4.1. Гексаціаноферрат калію K3[Fe(CN)6 ] утворює з іонами Fe2+ координаційну сполуку темно-синього кольору, нерозчинну у воді – осад турнбулевої блакиті:
3FeSO4 + 2K3[Fe(CN)6 ] = Fe3[Fe(CN6 ]2 + 3K2SO4
Реакцію проводять у нейтральному середовищі або в середовищі розбавленої НСl. Осад нерозчинний у кислотах, але розкладається лугами.
У пробірку вміщують одну краплину розчину солі Fe2+ і додають 3-4 краплини розчину К3[Fe(CN)6]. Утворюється темно-синій осад.
Інші катіони не заважають виявленню катіона Fe2+.
5.1.4.2. Диметилгліоксим (H2Dm, реактив Чугаєва) в амоніачному середовищі з йонами Fe2+ утворює внутрішньокомплексну сіль карміново-червоного кольору:
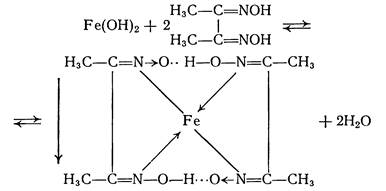
На скляну пластинку помістити 1 краплину розчину солі Fe2+, краплину H2Dm і краплину розчину амоніаку. Розчин забарвлюється в карміново-червоний колір.
Визначенню заважають йони ніколу.
5.1.4.3. Окиснення Fe2+ до Fe3+ будь-яким окисником – Н2О2, хлорною водою, бромною водою, нітратною кислотою, калій перманганатом:
5Fe2+ +MnO4 +8Н+ → 5Fe3+ + Mn2+ +4Н2О
|
|
Дата добавления: 2015-05-26; Просмотров: 443; Нарушение авторских прав?; Мы поможем в написании вашей работы!