
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровни Подуровни
|
|
|
|
Рис. 4.8. Энергия атомных орбиталей.
Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами. У s -эле-ментов валентными являются s-электроны внешнего энергетического уровня.
У р-элементов последним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены на p - и s -под-уровнях внешнего уровня. У d -элементов в последнюю очередь заполняется d -подуровень предвнешнего уровня и валентными являются s -электроны внешнего и d -электроны предвнешнего энергетического уровней.
У f-элементов последним заполняется f -подуровень третьего снаружи энергетического уровня.
Порядок размещения электронов в пределах одного подуровня определяется правилом Гунда:
в пределах подуровня электроны размещаются таким образом, чтобы сумма их спиновых квантовых чисел имела бы максимальное значение по абсолютной величине.
Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковым значением спинового квантового числа, а затем по второму электрону с противоположным значением.
Например, если в трех квантовых ячейках необходимо распределить 3 электрона, то каждый из них будет располагаться в отдельной ячейке, т.е. занимать отдельную орбиталь:
 |
В этом случае сумма спиновых квантовых чисел максимальна:
∑ms= ½ + ½ + ½ = 3/2.
Эти же 3 электрона не могут быть расположены иначе, так как ∑ ms будет меньше, например:
 |
∑ ms = ½ – ½ + ½ = ½.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией, или электронной формулой. Составляя электронную конфигурацию номер энергетического уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов на подуровне обозначается цифрой, которая записывается вверху у символа подуровня.
|
|
|
Электронная конфигурация атома может быть изображена в виде так называемой электронно-графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с различными значениями спиновых квантовых чисел.
Чтобы составить электронную или электронно-графическую формулу любого элемента следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
Так, например, атом водорода с порядковым номером 1 имеет 1 электрон. Водород - элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровне s -орбиталь, имеющую наименьшую энергию. Электронная формула атома водорода будет иметь вид:
1Н 1 s 1.
Электронно-графическая формула водорода будет иметь вид:
 1H 1s
1H 1s
Электронная и электронно-графическая формулы атома гелия:
2Не 1 s 2
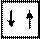 2Не 1 s
2Не 1 s
отражают завершенность электронной оболочки, что обусловливает ее устойчивость. Гелий – благородный газ, характеризующийся высокой химической устойчивостью (инертностью).
Атом лития 3Li имеет 3 электрона, это элемент II периода, значит, электроны расположены на 2-х энергетических уровнях. Два электрона заполняют s - подуровень первого энергетического уровня и 3-й электрон расположен на s - подуровне второго энергетического уровня:
 3Li 1 s 22 s 1
3Li 1 s 22 s 1
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1109; Нарушение авторских прав?; Мы поможем в написании вашей работы!