
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1. Желтый свет, испускаемый натриевой лампой, имеет
|
|
|
|
Задача 1. Желтый свет, испускаемый натриевой лампой, имеет
длину волны 589 нм. Какова частота этого излучения?
Дано: λ=589 нм
с =3∙108 м/с
ν=?
Решение. Из уравнения с= h∙ν находим ν = c/h. Подставляем в это уравнение значение с и h, преобразуя нм в м, получаем
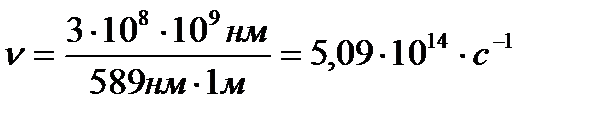
Задача 2. Вычислите мельчайшую порцию энергии (т.е. квант энергии)
желтого света с длиной волны 589 нм, которая может быть
поглощена телом.
Дано: λ =589нм
H=6,63∙108 м/с
c=3∙108 м/с
E?
Решение. Величина кванта энергии согласно уравнению Планка равна E=h∙ν. В задаче I найдено: 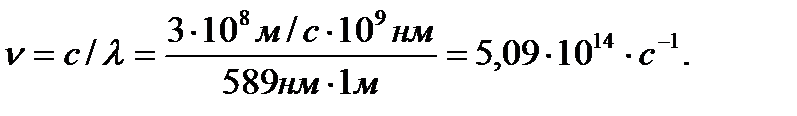
Зная ν, находим: ∆Е=hν =(6,63∙10-34 Дж∙(5,09∙1014 с-1)=3,37∙10-19 Дж. Согласно теории Планка атом или молекула, испускающая или поглощающая излучение с длиной волны 589 нм, могут терять или приобретать энергию излучения только порциями, кратными величине 3,37∙10-19 Дж. Они не могут, например, получить от такого излучения энергию 5,00∙10-19 Дж, поскольку это количество не является целочисленным кратным величине 3,37∙10-19Дж.
Задача 3. Вычислить в электронвольтах энергию возбуждения электрона в атоме магния, если пары его поглощают фотоны с длиной волны 6600∙10-19 м.
Дано: h=6,63∙10-34Дж с
c=3,00∙108 м/с
λ=6,600∙10-10м,
∆Е=?
Решение. Энергия возбуждения электрона равна энергии поглощаемого фотона, которую можно рассчитать по уравнению Планка Е = h∙ν и по соотношению ν = c/λ. Согласно этим двум уравнениям записываем выражение для энергии возбужденияфотонаЕ = h∙ν = h∙ c/λ:
Е = 6,63∙10-34 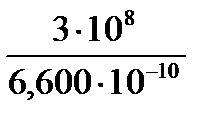 =3,410-19 Дж.
=3,410-19 Дж.
Сделаем пересчет Дж в эВ, исходя из того, что 1 Дж = 0,624∙10-19 эВ; отсюда Е возбуждения будет равна Е = 3,4∙10-19 0,624∙10-19 = 2,12∙10-39 эВ.
Задача 4. Вычислить массу фотона,соответствующую линии серии
|
|
|
Бальмера, если отвечающая ей длина волны λ равна 6563∙10-10м.
Дано: h = 6,63∙10-34 Дж с
C = 3∙108м/с
λ = 6563 10-10 м
mфотона –?
Решение. Из уравнения Луи де Бройля 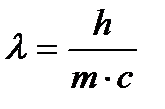 находим, что m = h/λc.Подставляя числовые значения, получим, что
находим, что m = h/λc.Подставляя числовые значения, получим, что
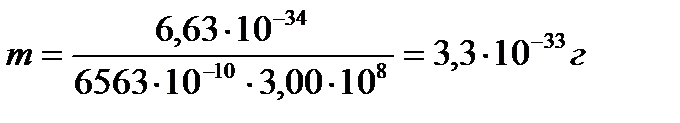
Задача 5. Вычислите длину волны де Бройля, которая соответствует
электрону с массой 9,1∙10-31 кг, движущемуся со скоростью
6∙106 м/с.
Дано: ml = 9,1∙10-31кг
Vф = 6∙106 м/с
h = 6,63∙10-34 Дж
λ –?
Решение. Подставляя имеющиеся значения в уравнение де Бройля 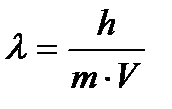 , получим
, получим
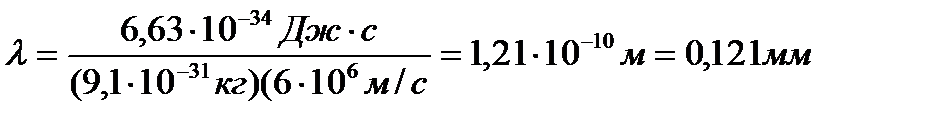
Задача 6. Вычислить частоту линии в спектре атомарного водорода,
которая соответствует переходу электрона из состояния
с n=4 в состояние n = 2.
Дано: ni - квантовое число исходной орбиты=4
nf -квантовое число конечной орбиты=2
ν =?
Решение. Подставим в уравнение (3) значения ni =4 и nf=2, так как это и есть квантовые числа, исходной и конечной орбит соответственно:
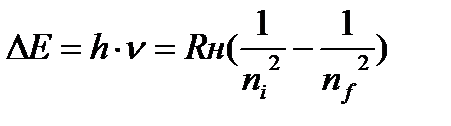 (3)
(3)
Отсюда
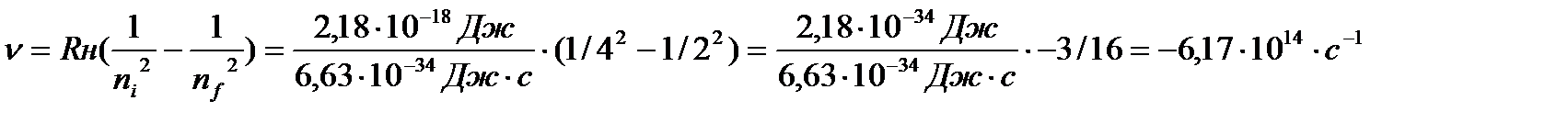 Задача 7. Вычислите энергию, необходимую для ионизации электрона из
Задача 7. Вычислите энергию, необходимую для ионизации электрона из
основного состояния атома водорода.
Дано: Rн = 2,18 ∙10-18 Дж
nf = ∞
ni = 1
∆Е=?
Решение. Энергию ионизации можно записать как разность между энергиями конечного состояния nf и исходного состояния ni: 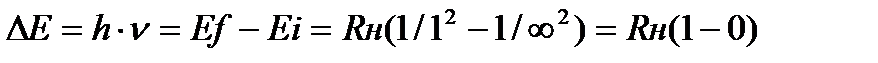 .
.
Следовательно, ∆E = Rн =2,18∙10-18Дж, полученную величину удобнее выражать в расчете на моль атомов. Для этого ее нужно умножить на число
Авогадро:∆Е = (2,18 ∙ 10-18) Дж/атом · (6,02 ∙ 1023 атомов/моль)/1000= =1,31∙103 кДж/моль.
Задача 8. Определите энергию (эВ), которой обладает электрон,
находясь на втором энергетическом уровне в атоме водорода.
Дано: n= 2
E =?
Решение. Для решения задачи применим уравнение (1): En= - Rн z2/n2 · Е = -13,6 z2/n2, где z- заряд ядра атома, nномер энергетического уровня. Энергия электрона на втором энергетическом уровне равна E=13,6∙1/22 эВ = 3,40 эВ.
Задача 9. Длины волн линий Нα и Нβ серии Бальмера ооответственно
равны 6563∙10-10 и 4102∙10-10 м. Во сколько раз масса одного
|
|
|
фотона (какого?) больше массы другого?
Дано: h=6,626∙10-34 Дж с
с=3∙108 м/с
Нα=6563∙10-10м
Hβ=4102 ∙10-10м
mH β / mНα=?
Решение. Массу протона вычисляют по уравнению де Бройля, принимая скорость фотона равной скорости света с = 3∙108 м/с:

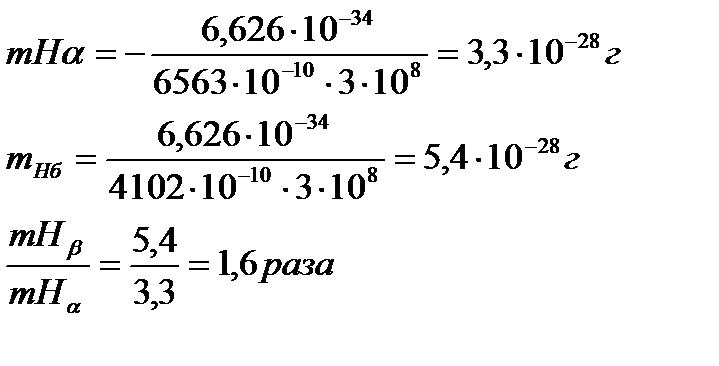
Ответ: mH β в 1,6 раза больше mHα.
Задача 10. Определите частоту излучения и длину волны 2-й
линии (Hβ) серии Бальмера спектра атомарного водорода.
Дано: h=6,63∙10-34Дж с
Rн=3,29∙10-15
или 2,18∙10-18 Дж/ат; υ -? λ -?
Решение. Линия Hβв серии Бальмера атомарного спектра водорода образуется при переходе электрона из состояния n=4 в состояние n =2.
Подставим в уравнение (3) n=4 и n=2, так как это и есть квантовые числа исходной и конечной орбит соответственно:
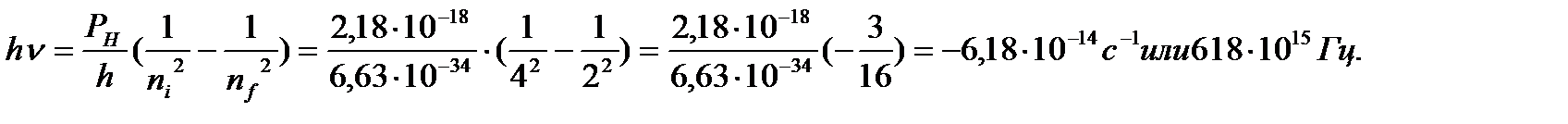 Отрицательный знак полученной величины указывает, что атом испускает свет. Из уравнения с = hν вычислим λ (длину волны излучения).
Отрицательный знак полученной величины указывает, что атом испускает свет. Из уравнения с = hν вычислим λ (длину волны излучения).
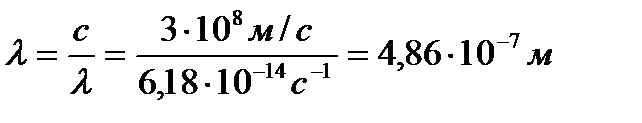 или 4860А0
или 4860А0
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3464; Нарушение авторских прав?; Мы поможем в написании вашей работы!