
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общими организаторами цитоскелета могут быть микротрубочки
|
|
|
|
11-34
11.6.4. Относительная роль актиновых филамептов и микротрубочек в миграции зависит от типа клеток [61]
При миграции клеток микротрубочки и актиновый цитоскелет обычно работают совместно, так что вклад их разделить трудно. Степень участия микротрубочек в направленном движении клетки у разных типов клеток различна. Если деполимеризовать микротрубочки фибробласта колхицином, он перестает двигаться в определенную сторону и начинает выпускать ламеллоподии в случайных направлениях. С другой стороны, на направленное движение нейтрофила колхицин практически не влияет. Более того, если нейтрофил кратковременно прогреть до 42 "С, значительная часть его кортикальной цитоплазмы отделяется от остальной клетки и начинает двигаться сама по себе. Хотя эти подвижные фрагменты клеток лишены микротрубочек и ядра, они способны ползать по культуральной чашке в течение дня и дольше, прежде чем подвергнутся распаду (рис. 11-82). Поначалу фрагменты обладают такой же способностью к хемотаксису, как и исходные нейтрофилы; например, они направленно движутся «вверх» по градиенту концентрации N-формилированных пептидов (разд. 11.2.13). Однако миграция прекращается, если актиновые нити в нейтрофилах (или в образовавшихся из них фрагментах) деполимеризовать цитохалази-ном. По-видимому, этим клеткам для направленной миграции необходимы актиновые филаменты, но не микротрубочки.
Однако движение конусов роста нервных клеток, судя по всему, зависит и от микротрубочек, и от актиновых филаментов. В аксонах и дендритах (обобщенно называемых нейритами) содержатся необычайно упорядоченные пучки микротрубочек. Каждый нейрит «вытягивается» из тела нервной клетки под действием тянущей силы, создаваемой конусом роста на его кончике. Если нервные клетки в культуре обработать колхицином, рост нейритов останавливается, что указывает на участие микротрубочек в продвижении конуса роста. Конус роста эквивалентен переднему краю нейтрофила или фибробласта, и формирование на нем ламеллоподий и микрошипов тоже зависит от актиновых филаментов и подавляется при обработке цитохалазином. Тем не менее у нервных клеток, растущих на высокоадгезивной поверхности (например, на культуральной чашке, покрытой поликатионом полилизином), нейриты будут расти и в присутствии цитохалазина, хотя направление их
|
|
|
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
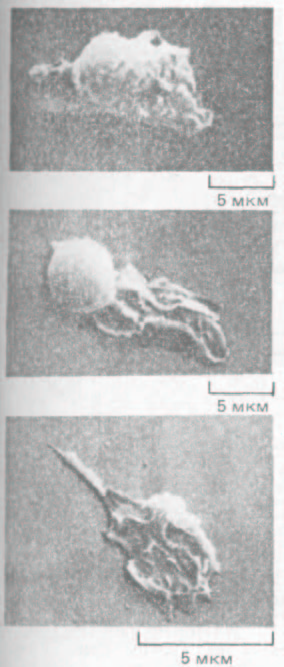
Рис. 11-82. Нейтрофил, нз которого в результате кратковременной тепловой обработки (42°С) был получен большой фрагмент, способный к непрерывному движению и хемотаксису, хотя в нем не было ядра и митохондрий. Микрофотография, полученная с помощью сканирующего электронного микроскопа. (S. R. Malawista и A. DeBoisfleury Chevance, J. Cell Biol. 95: 960-973. 1982; с разрешения Rockefeller Univ.
Press.)
роста будет меняться неупорядоченным образом. По-видимому, ламеллоподии и микрошипы нужны для того, чтобы направлять конус роста и позволять ему преодолевать слабоадгезивные поверхности. Организация микротрубочек и актиновых филаментов в конусе роста и в переднем крае фибробласта для сравнения показана на рис. 11-83.
11.6.5. Натяжение актинового кортекса, возможно, помогает управлять движением животных клеток [62]
Каков молекулярный механизм продвижения клетки вперед? Ответа на этот ключевой вопрос пока нет. Одна из гипотез, отводящая главную роль актиновому кортексу, представлена на рис. 11-84. Есть четкие свидетельства того, что кортекс в животных клетках находится в натянутом состоянии. Это натяжение кортекса, которое удалось измерить в очень крупных клетках, например в яйцеклетках морского ежа, стремится придать клеткам суспензии сферическую форму (т.е. такую, при которой их поверхность минимальна). Кроме того, клетки, видимо, способны «расслаблять» кортекс в определенных участках своей поверхности, например в переднем крае, хотя механизм этого расслабления неизвестен. В результате на переднем крае периодически образуются ламеллоподии - предположительно вследствие активации в плазматической мембране специальных кэпирующих белков, которая позволяет субъединицам актина присоединяться к плюс-концам актиновых филаментов в этом участке (разд. 11.2.15). Те ламеллоподии, которым не
|
|
|
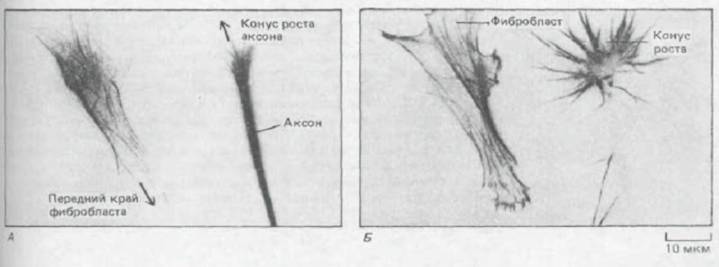
Рис. 11-83. Организация микрогрубочек и актиновых филамектов в подвижных клетках двух типов. Окраска антителами к тубулину, меченными флуоресцеином (А), выявляет микротрубочки в виде тонкой сети во всей цитоплазме фибробласта и в виде плотного пучка, идущего по оси аксона. При окраске тех же клеток родамин-фаллоидином (Б) видны актиновые филаменты как пучки, которые в фибробласте тянутся к переднему краю, а в аксоне концентрируются в микрошипах конуса роста. (С любезного разрешения Peter Hollenbeck.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
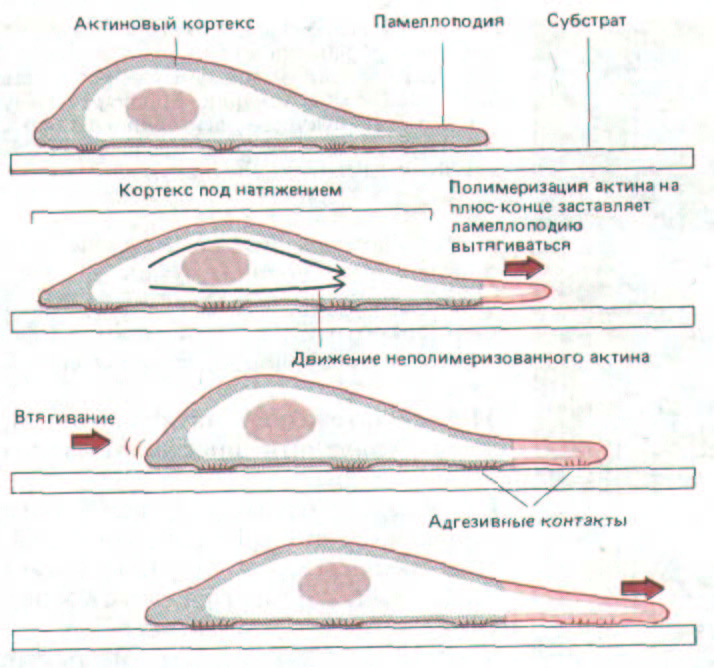
Рис. 11-84. Одна из моделей, показывающая, как богатый актином кортекс мог бы продвигать клетку вперед. Полимеризация актина ведет к вытягиванию ламеллоподии на переднем крае; прикрепившись к субстрату, ламеллоподия растягивает актиновый кортекс, и в результате его натяжения тело клетки продвигается вперед, частично ослабляя это натяжение. Такой цикл может повторяться снова и снова, шаг за шагом продвигая клетку.
удалось прочно прикрепиться к субстрату, оттягиваются назад за счет кортикального натяжения, и это приводит к «раффлингу» (см. рис. 11-42). Но если какая-нибудь ламеллоподия прочно прикрепится, то ее актиновые филаменты будут связаны с субстратом при помощи трансмембранных соединительных белков (см. рис. 11-43); теперь то самое натяжение кортекса, которое оттягивало свободную ламеллоподию назад, будет двигать всю клетку вперед к новой точке прикрепления (см. рис. 11-84).
|
|
|
По аналогии с мышцей - наиболее изученной двигательной системой на основе актина - можно было бы ожидать, что вызывающие сокращение силы в кортексе создаются при взаимодействии актиновых и миозиновых филаментов. Однако против этой возможности говорят эксперименты с клеточным слизевиком Dictyostelium discoideum (разд. 14.3.1). Удалось получить таких мутантов этого слизевика, у которых нормальный ген фибриллярного миозина был заменен искусственно модифицированным геном. В этом гене был вырезан длинный участок, кодирующий белок (см. разд. 4.6.14), и в результате эти мутанты были лишены миозиновых нитей. Неудивительно, что у мутантных клеток не могло формироваться сократительное кольцо, и поэтому они превращались в гигантские многоядерные клетки, которые лишь изредка делились, просто разрываясь надвое. Тем не менее эти клетки сохраняли способность к миграции и даже к хемотаксической реакции на сАМР (разд. 14.3.2), хотя оба процесса были заметно нарушены. По-видимому, координированное перемещение клетки, так же как и натяжение кортекса, не зависит всецело от биполярных миозиновых филаментов; возможно, что натяжение может создаваться эластичной сетью актиновых филаментов (действующей подобно резиновой пленке) или другими стягивающими силами, источником которых могли бы быть, например, процессы разборки актиновых филаментов или мини-миозин.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
11.6.6. Движению переднего края мигрирующей клетки может способствовать эндоцитозный цикл [63]
Как уже говорилось в гл. 6, все животные клетки непрерывно «заглатывают» небольшие участки своей плазматической мембраны и возвращают их обратно на клеточную поверхность в процессе, получившем название эндоцитозного цикла (разд. 6.5), Есть данные о том, что у ползущих по субстрату поляризованных клеток кусочки мембраны переходят внутрь со всей поверхности клетки, а возвращаются главным образом на передний край. По-видимому, такая асимметрия эндоцитозного цикла мигрирующей клетки помогает продвижению переднего края (разд.
|
|
|
6.5.13). Вероятно, возврат перешедших в цитоплазму участков мембраны на передний край поляризованной клетки зависит от ориентированных микротрубочек и актиновых филаментов: те и другие способны при участии вспомогательных белков направлять активный транспорт мембранных пузырьков в сторону своих плюс-концов (разд. 11.1.10 и 11.4.9). Таким образом, в мигрирующей клетке есть по меньшей мере два типа направленных «движителей», обеспечивающих ее локомоцию: 1) механизм на основе актиновых филаментов в клеточном кортексе - он выдвигает ламеллоподии и создает кортикальное натяжение; и 2) механизм, находящийся в глубине клетки, для которого нужны ориентированные микротрубочки или актиновые филаменты (или те и другие),- он обеспечивает активный транспорт мембранных пузырьков к переднему краю клетки (рис. 11-85).
Помимо участия в движении клеток микротрубочки играют также ключевую роль в определении их формы. Всем эукариотическим клеткам свойственна определенная геометрия, которая проявляется как во внешней структуре клетки, так и в расположении органелл. В то время как все другие компоненты цитоскелета лишь отражают эту геометрию, микротрубочки, по-видимому, часто играют уникальную роль в ее создании. Хорошо известно, например, что микротрубочки обычно располагаются вдоль длинной оси клетки и что во многих случаях их присутствие необходимо для поддержания удлиненной формы клетки в целом.
Как уже упоминалось, микротрубочки определяют положение аппарата Гольджи и эндоплазматического ретикулума в каждой клетке (разд. 11.4.10), а также влияют на распределение промежуточных филаментов, которые спадаются в околоядерную шапку при обработке клетки колхицином (разд. 11.5.3); кроме того, от них может зависеть и распределение актиновых нитей. Сократимое кольцо, которое постро-
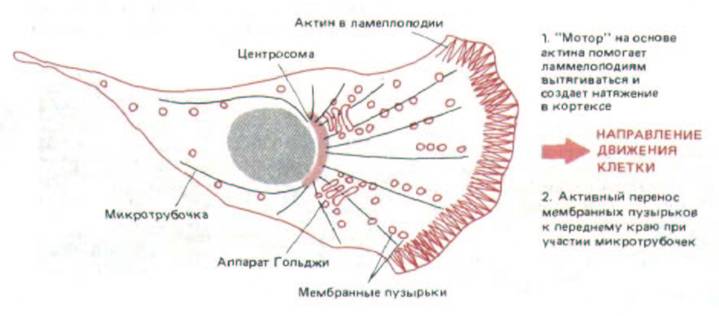
Рис. 11-85. Два направленных «двигателя» в мигрирующей клетке: в основе одного лежат актиновые филаменты кортекса, а другой основан на переносе мембранных пузырьков к переднему краю вдоль микротрубочек (и, возможно, актиновых филаменюв). Вероятно, эти механизмы совместно обеспечивают движение клетки в одном направлении.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ено из актиновых филаментов и перетягивает клетку пополам при завершении клеточного деления, всегда образуется в плоскости, перпендикулярной оси митотического веретена. Если образующееся веретено механически сместить, то соответственно изменится и место, где образуется затем сократимое кольцо; значит, положение этого кольца определяется положением веретена (разд. 13.5.13).
Механизмы, с помощью которых микротрубочки влияют на положение актиновых филаментов кортекса и промежуточных филаментов, неизвестны, хотя предположительно в них участвуют белки, образующие связи между белковыми нитями разных типов.
11.6.8. Структурная организация цитоскелета одной клетки может передаваться соседним клеткам [64]
Цитоскелет данной клетки может влиять на цитоскелет ее соседей. Как полагают, этот способ межклеточной коммуникации играет важную роль в определении морфологии тканей и органов. Один из простейших видов взаимодействия между цитоскелетами можно наблюдать, когда передние края двух мигрирующих клеток касаются друг друга. У клеток большинства типов это вызывает немедленный «паралич» переднего края у той и другой клетки - феномен, известный как контактное ингибирование движения. В результате два столкнувшихся in vitro фибробласта перестают вытягивать микрошипы и ламеллоподии в зоне соприкосновения и начинают выпускать их повсюду, кроме этого места, так что постепенно клетки «уходят» друг от друга, меняя направление движения (рис. 11-86). По-видимому, такая реакция связана с быстрыми изменениями в кортикальном актиновом цитоскелете в зоне контакта, но молекулярные механизмы этих изменений не выяснены.
Контактное ингибирование движения не следует смешивать с контактным ингибированием (торможением) клеточного деления', последнее наблюдается у клеток в культуре, которые делятся до тех пор, пока не покроют всю поверхность культуральной чашки. Как мы увидим в гл. 13, остановка роста и пролиферации в этих условиях зависит не только от контакта между клетками; она зависит также от той формы, которую клетки вынуждены принимать в условиях скученности, и от возрастающего дефицита питательных веществ (разд. 13.3.5).
Контактное ингибирование движения играет важную роль в заживлении ран. Пласты эпителиальных клеток на краях раны, вытягивая ламеллоподии, начинают быстро двигаться, стремясь «наползти» на поврежденную поверхность; это движение прекращается, как только клетки различных краев вступают в контакт, закрыв щель раны. Теперь. когда непрерывный пласт клеток восстановлен, между новыми соседями образуются межклеточные соединения, которые становятся точками прикрепления для белковых филаментов, соединяющих цитоскелеты всех клеток пласта (разд. 14.1.2). Контактное ингибирование движения может
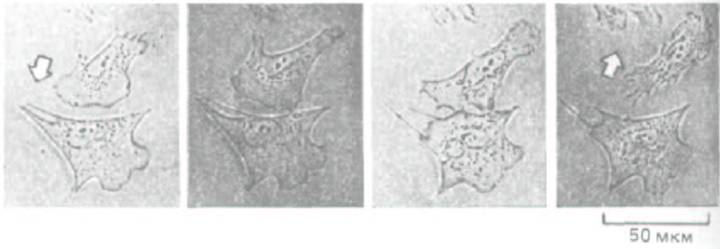
Рис. 11-86. Контактное торможение движения фибробластов. Если два ползущих по поверхности культуральной чашки фибробласта сталкиваются, их ламеллоподии в точке контакта парализуются. Спустя 10-15 мин клетки обычно начинают двигаться в разные стороны друг от друга. (С любезного разрешения Graham Dunn.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
также способствовать избирательному объединению аксонов в пучки в развивающейся нервной системе: конусы роста центральных нейронов останавливаются и даже втягиваются обратно, если сталкиваются с аксонами нейронов периферической нервной системы, хотя вдоль аксонов других центральных нейронов они продолжают охотно расти.
Еще один механизм, с помощью которого цитоскелет одной клетки может оказывать влияние на цитоскелет ее соседей, обусловлен взаимодействием между цитоскелетом и секретируемым клеткой внеклеточным матриксом. Как выяснилось (см. гл. 14), клетка с ориентированным цитоскелетом нередко образует сходным образом ориентированный внеклеточный матрикс, а это в свою очередь влияет на ориентацию цитоскелетов в других клетках, соприкасающихся с таким матриксом (см. рис. 14-84). Так благодаря межклеточным взаимодействиям через места соединения клеток и внеклеточный матрикс организация цитоскелета отдельной клетки часто определяется не автономно самой этой клеткой, а организацией ткани в целом.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2453; Нарушение авторских прав?; Мы поможем в написании вашей работы!