
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изомерия, номенклатура
|
|
|
|
Как уже было замечено, молекулы моносахаридов содержат асимметрические атомы углерода, с чем связано существование нескольких оптических изомеров. Так, в молекуле единственной альдотриозы – глицеринового альдегида (гл. 1.7.1) один хиральный атом углерода, поэтому возможны только два энантиомера.
Разных изомерных альдотетроз в соответствии с числом хиральных центров возможно уже четыре. Относительная конфигурация моносахаридов определяется по конфигурационному стандарту – глицериновому альдегиду. С конфигурацией его хирального центра сравнивается конфигурация наиболее удалённого от карбонильной группы хирального атома углерода. Каждой альдозе D- ряда соответствует энантиомер (вещество L- ряда) с противоположной конфигурацией всех центров хиральности. У диастереомеров в принятой номенклатуре углеводов будут другие тривиальные названия, причём суффикс с окончанием - оза является общим и используется для названий всех моносахаридов:

D- эритроза L- эритроза D- треоза L- треоза.
Изомерные альдопентозы могут быть представлены следующими формулами Фишера:

D- рибоза L- рибоза D- ксилоза L- ксилоза
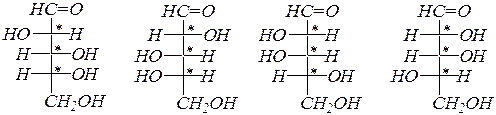
D- арабиноза L- арабиноза D- ликсоза L- ликсоза,
а изомерных альдогексоз будет ещё в 2 раза больше (здесь приведены только соединения D- стереохимического ряда):
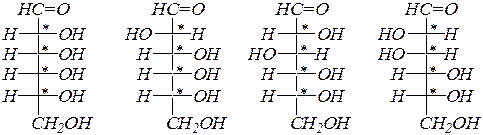
D- аллоза D- альтроза D- глюкоза D- манноза

D- тулоза D- идоза D- галактоза D- талоза.
Из кетоз наиболее широко распространены фруктоза и сорбоза:

D- фруктоза L- фруктоза D- сорбоза L- сорбоза.
Диастереомеры, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры ¾ частный случай диастереомеров. Например, эпимерами являются D- рибоза и D- ксилоза, отличающиеся друг от друга только конфигурацией атома С3, а также D- глюкоза и D- манноза, отличающиеся конфигурацией атома С2, и D- глюкоза и D- галактоза, отличающиеся конфигурацией атома С4.
|
|
|
Так как по химической структуре альдопентозы, альдогексозы, кетогексозы являются одновременно g-гидрокси- и d-гидроксикарбонильными соединениями, то они должны легко образовывать циклические полуацетали. Например, для D- рибозы:
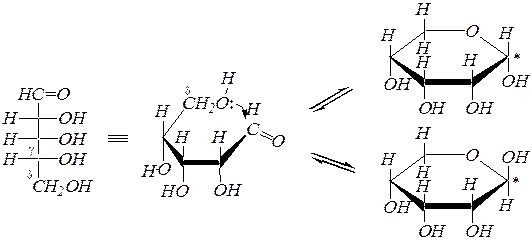
 .
.
В результате этого образуются четыре циклических формы, что связано с появлением ещё одного хирального центра (атома углерода, связанного с полуацетальным гидроксилом — в схеме отмечен звёздочкой). Полуацетальную гидроксильную группу в химии углеводов называют также гликозидной. Для изображения циклических форм моносахаридов приняты перспективные (пространственные) формулами, предложенными У. Хеуорсом* в 1926 г. (как показано в схеме).
При построении формул Хеуорса цикл условно считают плоским (на самом деле шестичленный цикл может быть в конформации кресла или ванны) и проецируют на плоскость под некоторым углом; при этом ближняя к наблюдателю часть кольца располагается снизу и обычно выделяется более жирной линией. Кислородный атом цикла располагают обычно на наибольшем удалении от наблюдателя. Атомы и группы атомов, изображаемые в формулах Фишера слева и справа, в формулах Хеуорса располагаются соответственно над и под плоскостью цикла. Боковые цепи при атомах С4 в альдопентозах и кетогексозах или С5 в альдогексозах изображают над плоскостью при D- конфигурации атома углерода и под плоскостью ¾ при L -конфигурации.
Образование циклического полуацеталя ¾ это пример таутомерного превращения. Такое явление в химии углеводов называется цикло-оксотаутомерией или кольчато-цепной таутомерией (о таутомерии — в гл. 3.8.2.1). В зависимости от того, за счёт какой гидроксильной группы (g- или d-) образуется та или иная циклическая форма, возможно существование пиранозных и фуранозных циклических форм, которые можно рассматривать как производные соответствующих гетероциклов пирана и фурана:
|
|
|

пиран фуран.
Образование пяти- и шестичленных циклов связано с их термодинамической устойчивостью по сравнению с малыми циклами (трёх- и четырёхчленными) и циклами большего размера.
В зависимости от расположения гликозидной (полуацетальной) гидроксильной группы относительно усреднённой плоскости кольца возможна дополнительная пара оптических изомеров, называемых аномерами (a-аномер и b-аномер). Аномеры представляют собой частный случай эпимеров. Принадлежность к a- или b-форме определяется конфигурацией аномерного атома углерода (для альдоз – это С1, для кетоз – это, как правило, С2). В молекуле a-аномера относительные конфигурации аномерного атома углерода и последнего асимметрического атома в углеродной цепи совпадают. В молекуле b-аномера, — наоборот, не совпадают. Или иначе принадлежность к a- или b-форме в формулах Хеуорса можно определить, сравнивая взаимное положение полуацетального гидроксила и группы атомов, не входящих в цикл (часто это СН2ОН группа). Цис- расположение этих групп определяет b-форму, транс- расположение ¾ a-форму. Например, D -глюкоза существует в следующих пяти формах:
 a-аномер
a-аномер
| 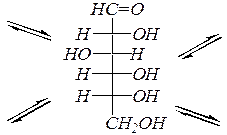
|  a-аномер
a-аномер
|
 b-аномер
b-аномер
|
 b-аномер.
b-аномер.
|
Полное название моносахарида включает обозначение конфигурации аномерного атома углерода (a- или b-) и размера цикла (пиранозный или фуранозный). Например:

a ,D- глюкопираноза b, D- рибофураноза.
Для кетоз образование циклических форм происходит аналогично альдозам. Например, фуранозные формы фруктозы:
 D- фруктоза
D- фруктоза
| 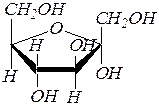 a ,D- фруктофураноза
a ,D- фруктофураноза
|
 b, D- фруктофураноза.
b, D- фруктофураноза.
|
В твёрдом состоянии все моносахариды находятся преимущественно в пиранозной форме, как самой устойчивой из возможных циклических форм. При кристаллизации из чистого растворителя можно получить чистые препараты a- и b-аномеров, так при перекристаллизации D- глюкозы из спирта получают a ,D- глюкопиранозу, а из пиридина — b ,D- глюкопиранозу. Разные аномеры (a- и b-) D- глюкозы различаются величиной удельного вращения: у a-аномера ¾ +112°, у b-аномера ¾ +19°. У свежеприготовленного раствора каждого аномера постепенно со временем происходит изменение удельного вращения до некоторого постоянного значения. В растворах образуется равновесная смесь всех циклических форм и оксоформы. Для водных растворов D- глюкозы этот угол +52,5°. Это происходит вследствие аномеризации, т.е. взаимопревращения a- и b-аномеров друг в друга через промежуточную оксоформу, и установления таутомерного равновесия. Связанное с этим явлением изменение угла вращения плоскости поляризованного света называется мутаротацией.
|
|
|
Различные конформации циклических форм моносахаридов можно рассматривать только для пиранозных циклов (фуранозное кольцо, аналогичное циклопентановому, почти плоское, и энергии конформационных переходов здесь минимальны). Пиранозное кольцо аналогично циклогексановому, для которого термодинамически более устойчива конформация «кресла». В целом на термодинамическую устойчивость пиранозных форм моносахаридов влияет пространственное расположение громоздких функциональных групп. С этим связано образование в большем или меньшем количестве того или иного аномера. Так, например, b, D- глюкопираноза ¾ моносахарид с полным экваториальным расположением заместителей:
 .
.
Поэтому, как считается, из-за высокой термодинамической устойчивости она обладает широкой распространённостью в природе.
Однако во многих случаях при оценке термодинамической устойчивости молекул моносахаридов для объяснения преобладания a- или b-аномерных форм и вообще распространённости в природе тех или иных моносахаридов необходимо учитывать возможность образования водородных связей, как внутримолекулярных, так и межмолекулярных.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2420; Нарушение авторских прав?; Мы поможем в написании вашей работы!