
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганатный метод
|
|
|
|
Химические методы определения массовой концентрации сбраживаемых углеводов
Методы основаны на окислении сахаров раствором Фелинга.
Метод основан на способности карбонильных групп сахаров восстанавливать в щелочной среде оксид меди (II) до оксида меди (I). При растворении железоаммонийными квасцами (железа (III) — аммония сульфат додекагидрат) образовавшийся оксид меди (I), окисляясь до оксида меди (II), восстанавливает железо ( III ) в железо (II).
Реакция идет по уравнению

Количество железа (II) определяют путем окисления перманганатом калия, которым оттитровывают полученный раствор:

В контроле спиртового производства этим методом определяют содержание редуцирующих углеводов в бражке.
Определение сахаров состоит из следующих стадий:
окисления сахаров с образованием оксида меди (II) и выпадения его в осадок;
фильтрования выпавшего оксида меди (II);
определения оксида меди (II) титрованием;
вычисления по таблицам количества сахара, соответствующего найденному количеству оксида меди (II) и проведения расчета.
Проведение анализа. Фильтрат бражки в количестве 25—30 см3 с содержанием углеводов около 0,09 г помещают в мерную колбу вместимостью 200 см3, приливают 10 см3 2,5%-ного раствора соляной кислоты, объем доводят до 100 см3 дистиллированной водой. Колбу закрывают пробкой с воздушным холодильником и помещают в кипящую водяную баню на 2 ч. Затем содержимое колбы охлаждают до 20 °С, нейтрализуют раствором гидроксида натрия, объем доводят до метки дистиллированной водой и перемешивают.
В коническую колбу вместимостью 100— 150 см3 наливают 20 см3 гидролизата бражки, добавляют по 20 см3 растворов Фелинга I и Фелинга II, перемешивают и нагревают до кипения, которое должно начаться не позднее 3—4 мин. Жидкость кипятят 3 мин. Началом кипения считают тот момент, когда пузырьки в жидкости поднимаются не только с середины колбы, но и по ее краям. Жидкость нагревают на электроплитке с асбестовой сеткой, в центре которой сделан вырез диаметром 5—6 см. После закипания жидкости нагрев уменьшают, не допуская вспенивания.
|
|
|
Через 3 мин колбу снимают с электроплитки и дают осесть осадку оксида меди (Cu20) за 1 —2 мин. Окраска раствора должна оставаться синей или голубой. Обесцвечивание раствора свидетельствует о том, что окисление сахара прошло не полностью. В этом случае анализ повторяют, предварительно разбавив анализируемый раствор водой.
Горячий раствор фильтруют через асбестовый или стеклянный фильтр под вакуумом при помощи водоструйного насоса.
При фильтровании жидкость осторожно сливают с осадка, а осадок промывают горячей дистиллированной водой, приливая ее в колбу с осадком. Промывные воды также осторожно сливают с осадка на фильтр. Эту операцию проводят до исчезновения щелочной реакции в промывных водах. При промывании и фильтровании следует следить за тем, чтобы слой оксида меди в колбе и на фильтре все время был покрыт жидкостью.
После промывания приемную колбу с промывными водами заменяют на другую. Промытый осадок оксида меди в колбочке растворяют, добавляя к нему 20 см3 раствора железа (III) — аммония сульфат додекагидрат (раствора железоаммонийных квасцов).
Полученную сине-зеленую жидкость сливают на фильтр, через который фильтровали осадок оксида меди, для растворения частичек меди, попавших в него. Осторожно перемешивают осадок стеклянной палочкой для более быстрого его растворения.
В процессе растворения вакуум-насос отключают, а по окончании растворения снова включают, и раствор отсасывают в чистую приемную колбу Бунзена. Коническую колбу и фильтр промывают несколькими порциями воды до исчезновения кислой реакции. Раствор и промывные воды собирают в приемную колбу и титруют раствором перманганата калия до появления розовой окраски.
|
|
|
Параллельно при тех же условиях проводят определение поправки на реактивы, заменяя анализируемый раствор 20 см3 дистиллированной воды. Поправку выражают в кубических сантиметрах раствора перманганата калия и при вычислении результатов ее значение вычитают из объема раствора КМп04, израсходованного на титрование анализируемого раствора. Полученные результаты умножают на поправочный коэффициент и получают объем стандартного раствора перманганата калия, 1 см3 которого соответствует 10 мг оксида меди.
Массу восстановленной меди (мг) определяют, умножая полученное значение объема стандартного раствора КМп04 на 10. По этой массе определяют массовую концентрацию сахара во взятой пробе.
Массовая концентрация редуцирующих углеводов (г/100 см3):
 (8)
(8)
где m- масса сахара, содержащегося в растворе, взятом на реакцию с растворами Фелинга, мг; V1-объем гидролтзата, см3; 100 – пересчет на 100 г бражки; V2- объем анализируемого раствора, взятого на гидролиз, см3; V3- объем гидролизата, взятого на определение содержания сахара, см3; 1000- пересчет в граммы.
Содержание сбраживаемых углеводов вычисляют по разности между содержанием редуцирующих углеводов и пентоз.
Пример. На анализ взяли 50 см3 бражки. Гидролизат разбавили водой до объема 200 см3 (К,). На титрование анализируемого раствора израсходовали 14,5 см3 раствора КМп04, поправочный коэффициент которого равен 0,55. Поправка на реактивы 0,1 см3. Массовая концентрация пентоз в бражке 0,480 г/100 см3. На титрование анализируемого раствору израсходовали стандартного раствора КМп04 (14,5 —0,1)0,55 = 7,92 см3, что соответствует 79,2 мг меди.
По таблице находим, что 79,2 мг меди восстанавливаются под действием 40,88 мг сахара (глюкозы).
Массовая концентрация редуцирующих углеводов в бражке (г/100 см3)
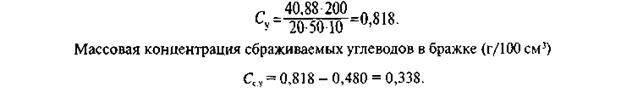
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 726; Нарушение авторских прав?; Мы поможем в написании вашей работы!