
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторный механизм
|
|
|
|
Обменный механизм.
При обменном механизме в образовании общей электронной пары от каждого атома участвуют атомные орбитали с неспаренными электронами:




 А + В А В
А + В А В
Например, образование молекулы Н2





s-AO s-AO σ-MO
или образование молекулы аммиака NH3





 H
H














H
Донорно-акцепторный механизм возникновения ковалентной связи наблюдается в том случае, когда один атом (донор) имеет неподеленную пару электронов, а другой (акцептор) – свободную орбиталь. При перекрывании атомных орбиталей возникает молекулярная орбиталь, на которой находится общая электронная пара.
АО АО МО






акцептор донор
Например, образование аммония NH4+ :






В молекуле аммиака у атома азота на внешнем уровне имеется неподеленная пара электронов, а у катиона водорода – свободная 1s- орбиталь.
При перекрывании атомных орбиталей пара электронов азота становится общей для соединяющихся атомов. Образующаяся четвертая ковалентная связь в катионе аммония полностью идентична по длине и энергии трем остальным ковалентным связям N – Н.
§2 Характеристики и свойства ковалентной связи.
1. Энергия связи – энергия, выделяющаяся в процессе образования связи и характеризующая прочность этой связи (Есв , кДж/моль).
|
|
|
Возникновение химической связи – самопроизвольный процесс и с точки зрения термодинамики ее образование сопровождается уменьшением энергии системы, а разрыв химической связи всегда требует затрат энергии. При образовании внутримолекулярных связей энергия составляет 100 – 1000 кДж/моль.
2. Длина связи – это расстояние между центрами атомов (lсв, нм, пм).
Длины связей с участием атома углерода зависят от его состояния гибридизации. Одинарные связи С – С имеют тенденцию к уменьшению длины с увеличением доли s-орбитали в гибридной.
Например, длина связи С – C равна 0,154нм; При увеличении кратности связей между двумя атомами их длина уменьшается. Например, длина двойной связи С=С равна 0,134нм, а тройная связь С≡С равна 0,120нм, что короче одинарной и двойной связей.
3. Валентный угол – это угол между связями, имеющими общий атом. Углы межъядерных связей Х – С – Y в органических молекулах должны соответствовать состоянию гибридизации атома углерода и быть равны 109,5º; 120º, 180º для sp³-, sp²-, sp- гибридного состояния соответственно.
4. Кратность связи характеризуется числом общих электронных пар между соединяемыми атомами.
При наличии одной общей электронной пары между соединяемыми атомами говорят о простой (одинарной) ковалентной связи, например в молекулах
Н2 (Н-Н), СН4, С2 Н6 (СН3 – СН3 ).
В приведенных молекулах все связи между атомами являются σ-связями.
При наличии двух или трех общих электронных пар между атомами возникает соответственно двойная или тройная связь. При этом одна связь обязательно σ-связь, остальные – π-связи. Например,
О2 (О=О), СН2 = СН2, СН≡СН, Н2 С=О
С увеличением кратности связи всегда уменьшается ее длина и повышается
суммарная прочность.
5. Полярность ковалентной связи. Ковалентная связь может быть полярной и неполярной.
Неполярная ковалентная связь образуется между атомами элементов, имеющих одинаковую электроотрицательность. В таких молекулах электронная плотность распределяется равномерно вокруг ядер соединяющихся атомов. К неполярным относятся молекулы простых веществ (О2, Н2 ) и между одинаковыми атомами в симметричных молекулах (СН3 – СН3, СН2 = СН2, НО-ОН, Н2N-NН2 ).
|
|
|
Полярная ковалентная связь образуется между атомами разных элементов, отличающихся по электроотрицательности. В таких молекулах электронная
плотность смещена к более электроотрицательному элементу. Это приводит к
появлению на атоме этого элемента эффективного отрицательного заряда δ-, а на другом атоме – эффективного положительного заряда δ+, например, в молекуле
Н2 О:

 Оδ - Нδ+
Оδ - Нδ+
Нδ+
Мерой полярности связи служит дипольный момент μ = δ ∙ l, где δ – заряд полюса диполя, а l – длина диполя. Единицей измерения полярности связи является Дебай (D) (1D=3,34 10-30 Кл∙м).
6. Поляризуемость связи – это способность электронной плотности связи смещаться под действием внешнего электрического поля или других воздействий. Во всех типах молекул (полярных и неполярных), в атомах и ионах под действием внешнего электрического поля происходит смещение электронной плотности молекулярной или атомной орбитали, в результате возникает индуцированный дипольный момент. Поляризуемость определяется легкостью смещения электронов связи. Легче поляризуются те связи, максимум электронной плотности которых располагается дальше от связываемых ядер. По поляризуемости π-связь значительно превосходит σ-связь.
7. Насыщаемость. Каждый атом в соединении способен образовывать определенное число ковалентных связей. Число возможных ковалентных связей, образуемых данным атомом, зависит от числа неспаренных электронов на внешних энергетических уровнях у атомов в основном и возбужденном состояниях, а также и от числа свободных атомных орбиталей на внешних уровнях.
В основном состоянии внешний уровень атома углерода имеет структуру




 2р
2р


 2s
2s
В этом состоянии углерод имеет два неспаренных электрона и может образовывать две ковалентные связи по обменному механизму. Однако углерод
в органических соединениях образует четыре связи. Это объясняется тем, что у
|
|
|
углерода имеется свободная 2р-орбиталь, которая в возбужденном состоянии может быть занята электроном за счет его перехода с 2s-орбитали:





 2р Е 2р
2р Е 2р 









 2s 2s
2s 2s
Распаривание неподеленной пары электронов и перенос одного электрона на свободную орбиталь требует затрат энергии, однако этот расход энергии компенсируется с избытком выделением энергии за счет образования атомом углерода четырех ковалентных связей вместо двух.
8. Направленность. Ковалентная связь направлена в сторону максимального перекрывания электронных орбиталей. По направлению различают σ- и π-связи.
σ-Связь образуется при перекрывании электронных орбиталей атомов вдоль линии, соединяющей центры атомов



π-Связь – это ковалентная связь, образованная при перекрывании электронных орбиталей в направлении, перпедикулярном линии, соединяющей центры атомов

Степень перекрывания электронных электронных орбиталей в случае σ-связи
больше, чем в случае π-связи, поэтому σ-связь более прочная.
Гибридизация атомных орбиталей; типы гибридизации
Направленность ковалентной связи определяет пространственную структуру молекулы, состоящей более чем из двух атомов. Для объяснения геометрии молекул или ионов с учетом направленности ковалентной связи. Л.Полинг предложил идею о гибридизации атомных орбиталей.
Гибридизация – это гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме.
Гибридные орбитали имеют форму несимметричной восьмерки

Такая форма обуславливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов и приводит к образованию более прочных связей. Название гибридных орбиталей определяется числом и типом участвующих орбиталей: sp-, sр2 -, sp3
В возбужденном состоянии атом углерода имеет следующее строение внешнего энергетического уровня
 2р
2р 





 2s
2s
sp3- Гибридизация. В этом случае в гибридизации участвуют одна s и три
|
|
|
р-орбитали с образованием четырех sp3-гибридных орбиталей. Эти орбитали направлены к вершинам тетраэдра под углом 109,5º. Данный вид гибридизации характерен для насыщенных соединений (алканы), например, метан и этан


метан этан
Длина связи С – С в алканах составляет 0,154нм, а длина С – Н – 0,110нм.
Энергия связи С – С – 350 кДж/моль, энергия связи С – Н – 414 кДж/моль.
sp2 -Гибридизация. В данном случае в гибридизации участвуют одна s и две
р-орбитали с образованием трех sp2-гибридных орбиталей. Эти орбитали направлены к вершинам равностороннего треугольника под углом 120º. Негибридная р-орбиталь перпендикулярна плоскости гибридных орбиталей.
Данный вид гибридизации характерен для ненасыщенных соединений (алкены), например, этилен СН2 =СН2
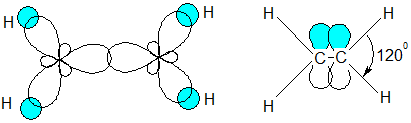
образование σ-связей образование π-связи
Длина связи С = С в алкенах 0,134нм, длина С – Н – 0,107нм.
Энергия связи С = С – 620 кДж/моль, энергия связи С – Н – 435 кДж/моль.
sр -Гибридизация. В данном случае в гибридизации участвуют одна s и одна
р-орбиталь с образованием двух sp-гибридных орбиталей. Эти орбитали лежат в одной плоскости под углом 180º. Две негибридные р-орбитали находятся во взаимно перпендикулярных и перпендикулярны плоскости гибридных орбиталей. Этот вид гибридизации характерен для ненасыщенных соединений, содержащих тройную связь (алкины). Например, ацетилен НС≡СН


образование σ-связей образование π-связей
Длина связи С≡С в алкинах 0,120нм; энергия связи С≡С - 814кДж/моль
§3 Ионная связь, ее возникновение. Особенности ионной связи.
При взаимодействии атомов, сильно отличающихся по электроотрицательности, общая пара электронов может быть практически полностью смещена к более электроотрицательному атому, превращая его в отрицательный ион. Другой атом в этом случае превращается в положительный ион. Между ионами действует электростатическое притяжение – ионная связь.
Ионная связь – это химическая связь между ионами, образованная за счет сил электростатического притяжения.
По существу ионная связь является сильно полярной ковалентной связью. Ионная связь наблюдается только в соединениях атомов типичных металлов с типичными неметаллами (например, галогениды щелочных металлов)

 ē ē
ē ē

 А + В А+ В- Li + F Li+F-
А + В А+ В- Li + F Li+F-
По мере сближения атомов возрастает сила притяжения, понижается энергия, атомные орбитали перекрываются, увеличивается электронная плотность в пространстве между ядрами. Вследствие большой разности в
электроотрицательности атомов электронная плотность в значительной степени смещается к атому галогена, так что вблизи равновесного межъядерного
расстояния силы притяжения можно считать приближенно электростатическими.
Особенностью ионной связи, в отличие от ковалентной, является ненаправленность и ненасыщаемость. Причина этого в том, что электрическое поле, создаваемое ионом имеет сферическую симметрию и действует на все другие ионы. Следствием ненаправленности и ненасыщаемости является ассоциация ионных молекул, образование димеров, тримеров и т.д.
§4 Водородная связь; виды водородной связи.
Особенности водородной связи.
Водородная связь возникает между атомом водорода и сильно электроотрицательным атомом (F, O, N, Cl). Различают межмолекулярые и внутримолекулярные водородные связи.
Природа водородной связи имеет электростатический и донорно-акцепторный механизм. Атом водорода способен взаимодействовать с неподеленной парой электронов сильно электроотрицательного атома этой же или другой молекулы с образованием дополнительной слабой связи, называемой водородной. При этом устанавливается равновесие


 - Х Н +:Y- -Х – Н …:Y-
- Х Н +:Y- -Х – Н …:Y-
Водородная связь очень слабая. Энергия большинства водородных связей лежит в пределах 10 – 40 кДж/моль, что значительно меньше энергии ковалентной или ионной связи.
Водородная связь оказывает влияние на физико-химические свойства молекул. Межмолекулярные водородные связи обуславливают ассоциацию многих соединений (спиртов, карбоновых кислот), что приводит к повышению их температур кипения. Сольватация веществ посредством образования водородных связей с растворителем резко повышает их растворимость. Водородные связи также вносят вклад стабильность ионизованных частиц в растворе:


ассоциация молекул спирта димер карбоновой кислоты
Внутримолекулярные водородные связи образуются в том случае, если в одной молекуле присутствуют атом водорода и электроотрицательный атом и возможно замыкание шести- или пятичленного цикла.
Например, наличие внутримолекулярных водородных связей в о-нитрофеноле и салициловом альдегиде обуславливает отличие их физических свойств от соответствующих мета- и пара-изомеров. Эти соединения не способны к ассоциации и поэтому имеют более низкие температуры кипения; не образуют водородные связи с водой и поэтому плохо в ней растворимы.
 о-нитрофенол
о-нитрофенол  салициловый альдегид
салициловый альдегид
Молекулы белков, нуклеиновых кислот и полисахаридов содержат много протонодонорных (>N-H и –O-H) и протоноакцепторных (>C=O, >N-) групп, склонных к образованию множества водородных связей между отдельными участками одной молекулы или между разными молекулами. В результате макромолекулы этих биополимеров приобретают определенную пространственную структуру, обеспечивающую их биологические функции. Разрыв водородных связей приводит к существенному изменению пространственной структуры макромолекул и их биохимических свойств.
§5. Индуктивный эффект.
Связующие электроны ковалентной связи расположены абсолютно симметрично между атомными ядрами лишь в случае одинаковых атомов (Н-Н, О=О).
Когда ковалентная связь соединяет атомы разной элктроотрицательности,
центр тяжести положительных зарядов ядер не совпадает с центром тяжести
 отрицательных зарядов электронов: связь приобретает дипольный момент μ=q∙l
отрицательных зарядов электронов: связь приобретает дипольный момент μ=q∙l
(q-заряд, l-расстояние между центрами тяжести зарядов). Полярность связи возрастает с увеличением разности электроотрицательностей связанных атомов. Полярную ковалентную связь в общем виде можно представить как Аδ+ :Вδ- . Знаки δ+, δ- обозначают направление поляризации: эти знаки обычно символизируют малые доли элементарного заряда

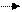
 Сδ+ Сlδ- Сδ+ Оδ-Н Сδ+=Оδ- Сδ+ Nδ- H2
Сδ+ Сlδ- Сδ+ Оδ-Н Сδ+=Оδ- Сδ+ Nδ- H2
Полярность одной ковалентной связи является причиной смещения электронной плотности соседних σ-связей также в сторону более электроотрицательного элемента.
Индуктивный эффект (I-эффект) – это передача электронного заместителей по цепи σ-связей.
Индуктивный эффект передается по цепи σ-связей с постепенным затуханием и, как правило, через две- три связи он уже не проявляется. В наибольшей степени этот эффект сказывается на ближайших соседних связях.
Направление индуктивного эффекта заместителя принято качественно оценивать путем сравнения с атомом Н, полагая его I-эффект равным 0.
Знак индуктивного эффекта принято определять по заряду, который приобретает заместитель.
Электроноакцепторные заместители, уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (-I).
δ'''+ δ''+ δ'+ δ-


 СН3 СН2 СН2 Х -IХ – эффект
СН3 СН2 СН2 Х -IХ – эффект
δ'''+ < δ''+ < δ'+
К электроноакцепторным заместителям (X) относятся
-F, - Cl, -Br, -I
-OH, -OR
-NH2, -NR2, -NR3
>C=O, -COOH
- NO2, - SO3H
Эти заместители оттягивают на себя общую электронную пару σ-связи и вызывают появление частичных положительных зарядов (δ+) на соседних атомах, например
δ'''+ δ''+ δ'+ δ-


 СН3 СН2 СН2 Cl -ICl – эффект
СН3 СН2 СН2 Cl -ICl – эффект
Электронодонорные заместители, увеличивающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I)
δ'''- δ''- δ' - δ+


 СН3 СН2 СН2 Y +IY – эффект
СН3 СН2 СН2 Y +IY – эффект
δ'''- < δ''- < δ'-
К электронодонорным заместителям (Y) относятся
алкильные группы -CH3 , -CH2 –CH3, -CH(CH3)2 , -C(CH3)3
анионы -О¯, -S¯, MgCl¯
атомы металлов Na, Mg, Al и т.д.
Эти заместители повышают электронную плотность в цепи и вызывают появление частичных отрицательных зарядов (δ-) на соседних атомах, например
δ'''- δ''- δ' - δ+


 СН3 СН2 СН2 MgCl +IMgCl – эффект
СН3 СН2 СН2 MgCl +IMgCl – эффект
§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
р-  и π-π- сопряжение.
и π-π- сопряжение.
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных
р-орбиталей.
Делокализованная связь – это ковалентная связь, молекулярные орбитали которой охватывают более двух атомов. р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя общую π-электронную систему.
Делокализованные молекулярные орбитали могут принадлежать двум или более
π-связям, тогда такой тип сопряжения называют π,π-сопряжением.
Примерами π,π- сопряженных систем являются



бутадиен – 1,3 винилацетилен акрилонитрил

изопрен акролеин
Простейшим представителем π,π- сопряженных систем является бутадиен-1,3. В его молекуле все атомы углерода находятся в sp2 –гибридизации: три sp2-гибридные орбитали каждого атома углерода лежат в одной плоскости под углом 120º. При их взаимном перекрывании и при перекрывании с электронными орбиталями атомов водорода образуется σ-скелет:

Негибридные р-орбитали каждого атома углерода перпендикулярны плоскости σ-скелета и параллельны друг другу, что способствует их взаимному перекрыванию и образованию единого π-электронного облака:

Результат такого сопряжения можно изобразить в виде граничных(или резонансных) структур:
δ+ δ-
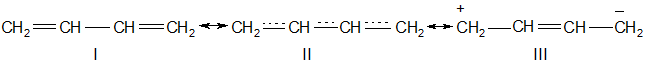
В реальной молекуле ни одна из структур I или III не осуществляется, а электроны занимают в молекуле стабильное положение, отвечающее в действительности структуре II.
Дополнительное перекрывание р-орбиталей приводит к делокализации
π-электронов в сопряженной системе и сопровождается
- выравниванием длины связи: l(C1-C2 , C3-C4) = 0,137нм, l(С2-С3)=0,147нм
- выделением энергии;
поэтому сопряженные соединения обладают меньшим запасом энергии. Они стабильнее, чем соединения с изолированными кратными связями. Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения (энергия резонанса).
р,π-Сопряжение осуществляется в том случае, когда орбитали двойных (или тройных) π-связей перекрываются с р-орбиталью соседнего атома и образуется единая делокализованная система π-электронов. р,π-Сопряжение осуществляется в молекулах, содержащих фрагмент С=С – Х:, где Х – гетероатом, имеющий свободную пару электронов на р-орбитали:

винилхлорид винилметиловый эфир ацетамид
Сопряженные системы с замкнутой цепью.
К этому типу систем относятся ароматические соединения: бензол и сходные с ним по строению и химическому поведению вещества, гетероциклические соединения, небензоидные ароматические соединения.
Бензол как прототип ароматических соединений:

Каждый атом углерода в молекуле находится в sp²-гибридизации; все σ-связи
С – С и С – Н лежат в одной плоскости под углом 120º; негибридизованные
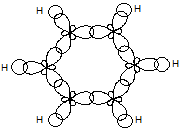

σ – скелет π-облако
р-орбитали перпендикулярны плоскости σ – скелета и параллельны друг другу. При взаимном перекрывании образуется единое шестиэлектронное π-облако, которое равномерно распределяется по всей циклической системе. Такое строение молекулы бензола приводит к выравниванию длины связи (lС-С =0,120нм) и выигрышу энергии (Есопряж.=150 кДж/моль). Это свидетельствует о повышенной термодинамической стабильности бензола.
§7 Мезомерный эффект.
В перераспределении электронной плотности в сопряженной системе под влиянием заместителя, главную роль играют π-электроны делокализованных ковалентных связей. При этом заместитель сам является участником сопряженной системы.
Мезомерный эффект (эффект сопряжения, М-эффект) – это передача электронного влияния заместителя по сопряженной системе.
Смещение подвижных электронов в результате мезомерного эффекта обозначается изогнутыми стрелками, начало которых показывает, какие π- или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются. В отличие от индуктивного эффекта, мезомерный эффект передается по сопряженной системе без затухания, так как π- и р-электроны более подвижны, чем σ-электроны.
Заместители, понижающие электронную плотность в сопряженной системе (оттягивают делокализованную электронную плотность на себя), проявляют отрицательный мезомерный эффект (- М–эффект) и являются электроноакцепторными. К ним относятся заместители, содержащие кратные связи атома углерода с более электроотрицательным гетероатомом:





акролеин акрилонитрил бензойная кислота
Заместители, повышающие электронную плотность в сопряженной системе (отдают свою пару электронов в общую сопряженную систему), проявляют положительный мезомерный эффект (+М–эффект) и являются электронодонорными. К ним относятся заместители, содержащие гетероатом с неподеленной парой электронов или имеющие отрицательный заряд:




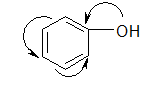
винилметиловый эфир винилхлорид фенол
Большинство функциональных групп проявляет и индуктивный, и мезомерный эффекты. Их действие может быть как однонаправленным, так и разнонаправленным. Поэтому при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие индуктивного и мезомерного эффектов.
§8 Задачи для самостоятельного решения
1. Определите состояние гибридизации атомов углерода в следующих
соединениях:
а) г)


б) д)

в) е)


2. Какие из приведенных соединений содержат в молекуле сильно полярные ковалентные связи
а) г)


б) д)


в) е)


3. Какие из приведенных заместителей проявляют в бензольном кольце положительный индуктивный эффект?
а) б) в)



г) д) е)



4. Какие из приведенных соединений относятся к π,π-, а какие к p,π-сопряженным системам:
а) г)


б) д)


в) е) 

5. В каких из приведенных соединений функциональные группы проявляют отрицательный мезомерный эффект?
а) г)

б) д)

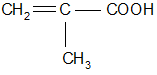
в) е)


6. Какие электронные эффекты проявляет гидроксильная группа в следующих соединениях?
а) в)


б) г)


|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 83; Нарушение авторских прав?; Мы поможем в написании вашей работы!