
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые методы получения циклоалканов
|
|
|
|
Изомеризация.
Дегидрирование.
Дегидрирование осуществляется при высокой температуре и в присутствии катализаторов: оксиды металлов (ZnO, Cr2O3, Fe2O3) – t ~ 450-650ºС; металлы (Рt, Ni, Pd, Fe) – t ~ 300ºС.
Алканы С2 – С4 при дегидрировании превращаются в алкены, алкины, алкадиены:

этан ацетилен этилен
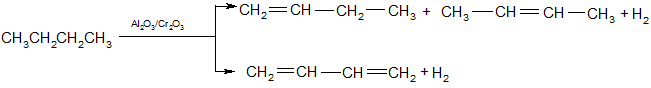
1,3 - бутадиен
н-Алканы с шестью или более углеродными атомами в присутствии катализатора дегидрируются в циклогексан или его гомологи с последующим дегидрированием в бензол или его производные:
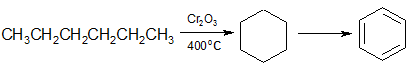
гексан циклогексан бензол
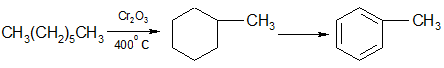
гептан метилциклогексан толуол
Под действием сильных электрофильных реагентов (кислот Льюиса)
н-алканы частично превращаются в изоалканы, а изоалканы – в н-алканы. Образуется равновесная смесь
 н-Алкан Изоалкан
н-Алкан Изоалкан
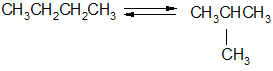
н-бутан изобутан
Применение
Применяются алканы в качестве топлива, смазочных масел; как исходные вещества в синтезе различных соединений: водорода, ацетилена хлороформа и других хлорпроизводных, фреонов, бутадиена (производство синтетических каучуков); в качестве растворителей смол, жиров, эфирных масел.
Парафин – смесь твердых алканов С18 – С35 в основном нормального строения; применяется в пищевой промышленности при изготовлении упаковочных материалов, в производстве товаров бытовой химии. Парафин является сырьем в производстве жирных кислот и спиртов, поверхностно-активных веществ.
В медицине используют в парафинолечении.
Вазелин – однородная мазеобразная масса, получаемая расплавлением парафина в минеральном масле; применяется для фармацевтических, медицинских, косметических целей. Вазелиновое медицинское масло применяется в медицине как слабительное средство, растворитель камфоры, компонент косметических мазей и кремов.
|
|
|
§4. Циклоалканы
Циклоалканы – это насыщенные углеводороды с замкнутой углеродной цепью.
Общая формула Сn Н2n
Циклоалканы классифицируют:
по размеру цикла
• малые циклы (С3 – С4); например

циклопропан циклобутан
• обычные циклы (С5 – С7); например

циклопентан циклогексан
• средние циклы (С8 – С11); например, циклооктан
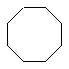
• макроциклы (С12 и более).
Изомерия циклоалканов:
1) по размеру цикла
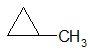

метилциклопропан циклобутан
2) по положению заместителей в цикле

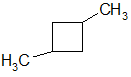
1,2 – диметилциклобутан 1,3 - диметилциклобутан
3) углеродной цепи в заместителе
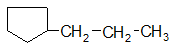 н-пропилциклопентан
н-пропилциклопентан
 изопропилциклопентан
изопропилциклопентан
4) межклассовая (циклоалканы изомерны алкенам)
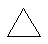
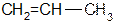
циклопропан пропен
5) геометрическая изомерия

цис-1,2-диметил- транс-1,2-диметил-
циклопропан циклопропан
6) конформационная.
Устойчивость конформеров ациклических соединений определяют
следующие факторы:
• напряжение, обусловленное искажением валентных углов;
• торсионное напряжение, связанное с отклонением от наиболее выгодной «заторможенной» конформации. В плоских циклах водородные атомы или замещающие их группы должны находиться в менее выгодной «заслоненной» конформации;
• напряжение, связанное с отталкиванием сближенных атомов;
• напряжение, обусловленное изменением межатомных расстояний.
Циклопропан существует только в одной плоской конформации. Искажение валентных углов при sp³-гибридизации орбиталей атомов углерода должно составлять (109º28´ - 60º): 2 = 24º44´ (угловое напряжение). Это наиболее напряженная циклическая система. В действительности угол между связывающими орбиталями углеродных атомов ~ 104º. Согласно квантовохимическим расчетам изменение угла является результатом изменения гибридизации атомов углерода. Гибридизация орбиталей в молекуле циклопропана ближе к sp²-гибридизации алкенов, чем к sp³-гибридизации алканов.
|
|
|
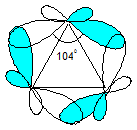
В циклобутане и особенно циклопентане угловое напряжение значительно ниже. При расположении всех атомов углерода в одной плоскости искажение валентных углов составляет соответственно
(109º28´ - 90º): 2 = 9º44´ и (109º28´ - 108º): 2 = 0º44´. Но эти кольца неплоские. Один из атомов углерода непрерывно выходит из плоскости; кольца находятся в колебательном движении.
В результате уменьшается «заслоненность» атомов водорода у соседних углеродных атомов и снижается напряжение.
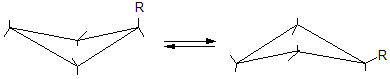 циклобутан
циклобутан
 циклопентан
циклопентан
В молекуле циклогексана могут быть сохранены обычные валентные углы при условии его существования в неплоских конформациях «кресло» или «ванны». Конформация «кресло» на 20,9 кДж менее напряжена. Поэтому циклогексан существует преимущественно в виде конформеров I и III, переходящие друг в друга с промежуточным возникновением конформера II:
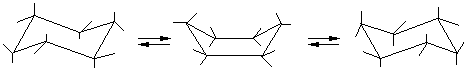
I II III
1. Из дигалогенпроизводных
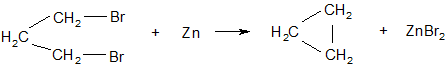
1,3 –дибромпропан циклопропан
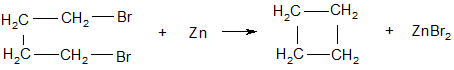
1,4-дибромбутан циклобутан
2. н-Алканы с шестью или более углеродными атомами в присутствии катализатора дегидрируются в циклогексан или его гомологи:

гексан циклогексан
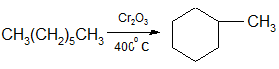
гептан метилциклогексан
3. Получение циклогесана и его гомологов
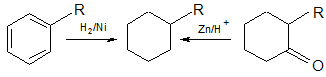
Физические свойства:
Циклопропан и циклобутан – бесцветные газы, нерастворимые в воде. Циклопропан обладает сильным общеобезболивающим действием, нетоксичен.
Циклопентан и циклогексан – бесцветные жидкости с характерным запахом, нерастворимые в воде.
§5. Химические свойства.
Рассмотрим химические превращения циклоалканов в зависимости от величины цикла.
1. Гидрогенолиз (присоединение водорода, протекающее с разрывом С – С связи):
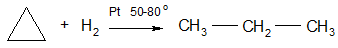
циклопропан пропан
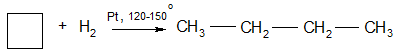
Циклобутан бутан
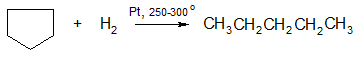
Циклопентан пентан
2.Галогенирование. Галогенирование циклопропанов может протекать с разрывом цикла (фотохимическое хлорирование при температуре выше 100ºС), а в более мягких условиях протекает реакция радикального замещения с сохранением цикла:
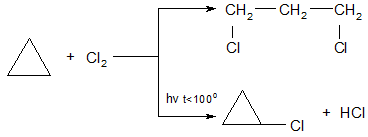
Циклобутан и его производные во многом подобны алканам; для них характерны реакции замещения:
|
|
|
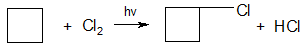
Циклопентаны и циклогексаны галогенируются подобно алканам по механизму радикального замещения:
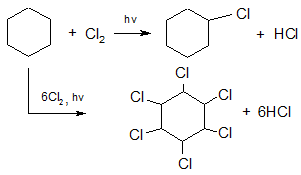
гексахлорциклогексан
3.Гидрогалогенирование; хлороводород и бромоводород присоединяются к циклопропану и его гомологам в водном растворе с разрывом цикла:
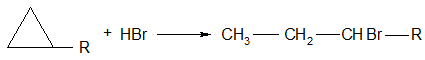
Реакция протекает по правилу Марковникова.
Остальные циклоалканы не реагируют с галогенводородами.
4. Окисление; при действии сильных окислителей циклоалканы образуют двухосновные карбоновые кислоты с тем же количеством атомов водорода:
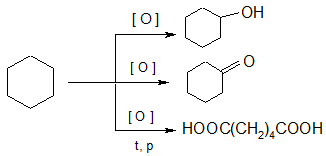 адипиновая кислота
адипиновая кислота
5. Дегидрирование циклогексана и его гомологов приводит к образованию ароматических соединений:

Бензол
Циклобутаны, циклопентаны, циклогесаны используются в органическом синтезе. Циклогексан применяется в качестве растворителя и как исходное в производстве капролактама и адипиновой кислоты. Циклогексановое кольцо является структурным звеном большого числа природных соединений (терпенов, стероидов).
§6. Алкены. Номенклатура, изомерия. Способы получения.
Алкены – это ряд ненасыщенных углеводородов, содержащие в цепи одну двойную углерод-углеродную связь. Общая формула СnH2n+2
Исторически сложившееся название этих углеводородов – олефины или ненасыщенные, так как они способны присоединять различные реагенты.
По систематической номенклатуре название алкенов образуют от названия соответствующего алкана, изменяя суффикс –ан на –ен. Цифрой указывают номер углеродного атома, после которого расположена двойная связь. Иногда используют рациональную номенклатуру; в ее основе лежит название первого члена гомологического ряда – этилен, все остальные заместители указываются в приставке.
СН2 = СН2 этен, этилен
СН2 = СН – СН3 пропен, пропилен
СН2 = СН – СН2 – СН3 1 – бутен
СН3 – СН = СН – СН3 2 – бутен
Правилами ИЮПАК разрешено использование нескольких несистематических названий алкенильных радикалов:
СН2 = СН – этенил, винил
СН2 = СН – СН2 – пропенил, аллил
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 117; Нарушение авторских прав?; Мы поможем в написании вашей работы!