
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронное строение
Атомы углерода, связанные двойной связью, находятся в sp²-гибридизации.Три sp²гибридные орбитали лежат в одной плоскости под углом 120º, направлены к
вершинам равностороннего треугольника и образуют прочные σ-связи. Негибридные р-орбитали каждого атома углерода перпендикулярны плоскости
σ-связей; при их перекрывании образуется π-связь. Прочность π-связи меньше, чем σ-связи. Строение этилена:

образование σ-связей: образование π-связи:

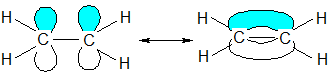
Длина двойной связи составляет 0,134 нм, энергия связи 620 кДж/моль.
Поворот по связи С=С в алкенах значительно затруднен, так как он вызывает разрушение π-облака, а это требует затрат энергии. Этим объясняется существование стабильных цис- и транс-изомеров, которые могут переходить друг в друга только при высокой температуре или при УФ-облучении.
§7. Химические свойства
Химические свойства алкенов определяются наличием двойной связи, содержащей π-электроны. π-Электроны характеризуются подвижностью, так как они менее прочно удерживаются ядрами атомов, чем σ-электроны. В результате двойная связь легко поляризуема и обладает электронодонорными свойствами, т.е. является нуклеофилом. Поэтому алкены склонны взаимодействовать с электрофилами и для них характерны реакции присоединения по двойной связи.
І. Реакции присоединения (АЕ)
1. Галогенирование
Наиболее легко алкены хлорируются и бромируются; процесс протекает при комнатной температуре и практически с количественным выходом:

Раствор брома в воде или в четыреххлористом углероде имеет бурую окраску, продукты присоединения брома бесцветны (качественная реакция на ненасыщенность).
Механизм реакции:

Brδ+ - Вrδ-
π-комплекс катион бромония

карбкатион
Процесс включает несколько стадий:
1. Молекула брома атакует двойную связь алкена; π-электронное облако поляризует связь Вr – Вr; образуется неустойчивая система – π-комплекс.
2. Электронодефицитный атом брома присоединяется к алкену; образуется циклический катион бромония, в котором атом брома связан с обоими атомами углерода, или карбкатион.
3. Нуклеофил Вr‾ атакует катион бромония (или карбкатион) с противоположной стороны, образуя продукт реакции.
|
|
Дата добавления: 2017-02-01; Просмотров: 59; Нарушение авторских прав?; Мы поможем в написании вашей работы!