
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение номинального объема и средней массы таблеток
|
|
|
|
Воды до 100,0
Натрия салицилата по 1,0
Гексаметилентетрамин
Димедрола 0,02
Воды очищенной до100,0 мл
Кальция хлорида по 2,0
Калия бромида
Воды до 100,0 мл
Кальция хлорида 0,02
Калия хлорида 0,02
Натрия хлорида 0,9
Воды до 100,0 мл
Кальция хлорида 0,02
Калия хлорида 0,02
Натрия хлорида 0,9
если на суммарное титрование хлоридов натрия, калия, кальция в 1,0 мл лекарственной формы израсходовано 1,55 мл 0,1 моль/л раствора серебра нитрата (К= 1,02), а на титрование кальция хлорида в 10,0 мл лекарственной формы – 0,95 мл 0,01 моль/л раствора трилона Б (К=0,99).
М (натрия хлорида) = 58,44 г/ моль; М (калия хлорида) = 74,56 г/ моль; М (кальция хлорида) = 219,08 г/ моль.
4. Рассчитайте примерный объем 0,1 моль/л раствора серебра нитрата (К= 0,98), который пойдет на титрование 1,0 мл раствора Рингера:
М (натрия хлорида) = 58,44 г/ моль; М (калия хлорида) = 74,56 г/ моль; М (кальция хлорида) = 219,08 г/ моль.
5. Приведите уравнения реакций количественного определения ингредиентов лекарственной формы:
1. Рассчитайте средний титр и объем 0,1 моль/л раствора серебра нитрата (К = 1,02), который пойдет на суммарное титрование калия бромида и кальция хлорида в 2,0 мл лекарственной формы.
2. Рассчитайте содержание действующих веществ, если на титрование кальция хлорида в 2,0 мл лекарственной формы пошло 3,85 мл 0,05 моль/л раствора трилона Б (К = 0,98), на суммарное титрование калия бромида и кальция хлорида в 1,0 мл анализируемого раствора – 3,6 мл 0,1 моль/ л раствора серебра нитрата (К = 1,01).
3. Оцените качество приготовления лекарственной формы в соответствии с приказом № 305. М (калия бромида) = 119,01 г/ моль; М (кальция хлорида) = 219,08 г/ моль;
6. Приведите уравнения реакций количественного определения ингредиентов лекарственной формы состава:
|
|
|
Раствора Кислоты борной 2% - 10,0 мл
1. Рассчитайте навеску лекарственной формы, чтобы на титрование димедрола пошло 1,0 мл 0,01 моль/л раствора серебра нитрата (К =1,01).
2. Рассчитайте средний титр димедрола и кислоты борной, объем 0,1 моль/л раствора натрия гидроксида (К = 1,00), который пойдет на их суммарное титрование в 1,0 мл лекарственной формы.
3. Рассчитайте содержание действующих веществ, если на титрование димедрола в 1,0 мл глазных капель пошло 0,7 мл 0,01 моль/л раствора серебра нитрата (К = 1,01), на суммарное титрование димедрола и кислоты борной в 1,0 мл глазных капель – 3,3 мл 0,1 моль/л раствора натрия гидроксида (К = 1,02).
Оцените качество приготовления лекарственной формы согласно требований приказа № 305.
7. Приведите уравнения реакций количественного определения ингредиентов лекарственной формы:
1. Рассчитайте навеску лекарственной формы, чтобы на титрование в ней натрия салицилата пошло 1,5 мл 0,1 моль/л раствора хлороводородной кислоты (К =1,01).
2. Рассчитайте средний титр и объем 0,1 моль/л раствора хлороводородной кислоты (К = 0,98), который пойдет на суммарное титрование гексаметилентетрамина и натрия салицилата в 2,0 мл лекарственной формы.
3. Рассчитайте содержание действующих веществ, если на суммарное титрование гексаметилентетрамина и натрия салицилата в 2,0 мл лекарственной формы пошло 2,8 мл 0,1 моль/л раствора хлороводородной кислоты (К = 1,01). При количественном определении натрия салицилата на титрование избытка 0,1моль/л (УЧ 1/6 КВrО3) раствора калия бромата (К = 0,98), добавленного к 3,0 мл лекарственной формы в количестве 20,0 мл, пошло 7,9 мл 0,1 моль/л раствора натрия тиосульфата (К = 1,00). На титрование контрольного опыта пошло 19,6 мл 0,1 моль/л раствора натрия тиосульфата.
4. Оцените качество приготовления лекарственной формы согласно требований приказа № 305. М (натрия бромида) = 102,90 г/ моль; М (натрия салицилата) = 160,11 г/ моль.
|
|
|
Список литературы для подготовки.
1. Беликов, В.Г. Фармацевтическая химия: Учеб. Для вузов. – Пятигорск, 2003.
2. Фармацевтическая химия: Учеб. Пособие / Под ред. А.П. Арзамасцева. – 2-е изд., испр. – М.: ГОЭТАР-Медиа, 2005.
Приложение 1.
Общие указания к самостоятельной работе студентов
Получив субстанцию, студенты в соответствии с НД должны провести оценку качества субстанции по показателям указанным в лабораторной работе.
На основании результатов, полученных по проверенным показателям, необходимо сделать заключение о соответствии или несоответствии препарата требованиям НД. Отчет о лабораторной работе оформляется в развернутом виде (в соответствии с принятой формой) и в виде заполненного аналитического паспорта
Получив таблетки, студенты в соответствии с ОФС и ФС (или ФСП) должны провести оценку их качества по следующим показателям: описание, подлинность, определение средней массы и однородности по массе, количественное определение, упаковка, маркировка. Другие показатели (распадаемость, растворение, тальк, посторонние примеси, микробиологическая чистота) рассматриваются ознакомительно.
До извлечения таблеток рекомендуется оценить соответствие упаковки и маркировки препарата требованиям ФС (ФСП). Возможно также получение препарата на анализ в нерасфасованном виде, в этом случае показатели маркировка и упаковка не оцениваются.
Внешний вид 20 таблеток (если не указывается иначе) оценивают на чистой, ровной, белой поверхности.
Определение средней массы таблетки и однородности по массе выполняют в соответствии с методикой ГФ XI, вып. 2, с. 154 (см. Приложение 2). На основании полученных результатов делают заключение о соответствии препарата требованиям по показателю средняя масса и однородность по массе. Для проведения качественного и количественного анализа действующего вещества в ступке тщательно растирают таблетки в количестве, указанном в задании (не все 20 как требует ОФС, в виде исключения).
На основании результатов, полученных по проверенным показателям, необходимо сделать заключение о соответствии или несоответствии препарата требованиям нормативной документации. Отчет по лабораторной работе оформляется в развернутом виде и в виде заполненного аналитического паспорта.
|
|
|
Получив инъекционный раствор, студенты в соответствии с ОФС и ФС (или ФСП) должны провести оценку его качества по следующим показателям: описание, прозрачность (если требуется), цветность (если требуется), номинальный объем, механические включения (на приборе для просмотра механических включений), рН раствора, подлинность, количественное определение действующего вещества (или действующих веществ), маркировка ампул, упаковка. Другие показатели (стерильность, пирогенность, посторонние примеси) рассматриваются ознакомительно и на занятии не оцениваются. В случае выдачи препарата на занятии в нерасфасованном виде (не в заводской упаковке), показатели «упаковка» и «маркировка» не оцениваются.
При выдаче препарата в ампулах сначала проводят проверку внешнего вида (описание), маркировки каждой ампулы и испытание на отсутствие механических  включений в соответствии с НД (ФСП), ОФС и РД-42-501-98. Затем ампулы необходимо вскрыть с помощью ампульного ножа и провести испытание на соответствие номинального объема. Раствор после проведения анализа аккуратно перелить в сухой пенициллиновый флакон (или в сухую коническую колбу емкостью 100 мл) и с полученным раствором провести остальные испытания: определить прозрачность и (или) цветность (если требуется), рН раствора, провести реакции подлинности и количественное определение действующего вещества. Расчет содержания действующего вещества в препарате производится в граммах в 1 мл раствора.
включений в соответствии с НД (ФСП), ОФС и РД-42-501-98. Затем ампулы необходимо вскрыть с помощью ампульного ножа и провести испытание на соответствие номинального объема. Раствор после проведения анализа аккуратно перелить в сухой пенициллиновый флакон (или в сухую коническую колбу емкостью 100 мл) и с полученным раствором провести остальные испытания: определить прозрачность и (или) цветность (если требуется), рН раствора, провести реакции подлинности и количественное определение действующего вещества. Расчет содержания действующего вещества в препарате производится в граммах в 1 мл раствора.
На основании результатов, полученных по проверенным показателям, необходимо сделать заключение о соответствии или несоответствии препарата требованиям НД. Отчет о лабораторной работе оформляется в развернутом виде (в соответствии с принятой формой) и в виде заполненного аналитического паспорта
Приложение 2.
I. Объем инъекционных растворов в сосудах должен быть больше номинального (табл 1). Объем заполнения инъекционного раствора в сосудах зависит от вязкости (невязкие и вязкие растворы) и номинального объема. Количество сосудов для контроля заполнения зависит от номинального объема
|
|
|
В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем, в сосудах вместимостью 50 мл и более – калиброванным цилиндром при температуре (20±2) 0С.
Таблица 1 Объем инъекционных растворов в сосудах
| Номинальный объем, мл | Объем заполнения, мл | Количество сосудов для контроля заполнения, шт | |
| невязкие растворы | вязкие растворы | ||
| 1,0 2,0 5,0 10,0 20,0 50,0 Более 50,0 | 1,10 2,15 5,30 10,5 20,6 51,0 На 2% более номинального | 1,15 2,25 5,50 10,70 20,90 51,5 На 3% более номинального |
II. Для определения средней массы таблеток и однородности по массе используют стеклянный или полимерный бюкс известной массы. Среднюю массу таблеток устанавливают взвешиванием вместе 20 таблеток с точностью до 0,001г и рассчитывают по формуле:
 , где
, где  - суммарная масса 20 таблеток, г.
- суммарная масса 20 таблеток, г.
.
Для определения отклонения отдельных таблеток от средней массы взвешивают порознь каждую из 20 таблеток с точностью до 0,001 г.
Oтклонения отдельной таблетки от средней массы рассчитывают в %
по формуле:

где: 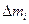 - отклонение отдельной испытуемой таблетки от средней массы, %;
- отклонение отдельной испытуемой таблетки от средней массы, %;
 - масса таблетки, г;
- масса таблетки, г;
 - средняя масса таблеток.
- средняя масса таблеток.
Результаты оформить в виде таблицы:
| № п/п | 
| 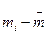
| 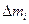 , % , %
|
| … | |||
Полученное значение средней массы таблетки оценивают в соответствии с нормативами, приведенными в фармакопейной статье на соответствующую лекарственную форму в разделе «Средняя масса таблетки». Отклонения отдельных таблеток от средней массы (за исключением таблеток, по крытых оболочкой методом наращивания) оценивают, исходя из следующих допустимых пределов:
- для таблеток массой 0,1 г и менее ±10%,
- для таблеток массой более 0,1 г и менее 0,3 г ±7,5%;
- для таблеток массой 0,3 г и более + 5%.
Для таблеток, покрытых оболочкой методом наращивания, масса отдельных таблеток не должна отличаться от средней массы более чем на ± 15%.
Отклонение отдельных таблеток считается соответствующим требованиям нормативной документации, если все значения отклонения от средней массы укладываются в допустимые пределы или только для двух таблеток превышают соответствующие допустимые пределы, но не более чем в 2 раза.
III. Среднюю массу (или однородность по массе) суппозиториев определяют взвешиванием 20 суппозиториев с точностью до 0,01г. Расчеты проводят по аналогии с определением средней массы (отклонения в массе) таблеток. Отклонение в массе не должно превышать ±5% и только да суппозитория могут иметь отклонения ±7,5 %
Распадаемость. (не более 15 мин в воде)
Согласно ГФ XI, вып. 2, с. 154 определяют на лабораторном идентификаторе процесса распадаемости при температуре (37 + 2)OC, используя в качестве растворителя воду, если таблетки не покрыты кишечнорастворимой оболочкой. Для проведения испытаний отбирают 18 таблеток. В каждую из 6 стеклянных трубок сборной корзинки помещают по 1 таблетке и вносят в сосуд с водой при температуре(37 + 2)OC. С помощью специального электромеханического устройства сообщают корзинке возвратно-поступательное движение в вертикальной плоскости при частоте 28-32 цикла в 1 минуту на расстояние не менее 50 мм и не более 60 мм. Испытание проводят в течение времени, указанного в частной статье для соответствующей формы. Все образцы должны полностью распасться, о чем судят по отсутствию частиц на проволочной сетке (с диаметром отверстий 2 мм) нижнего диска, за исключением случаев, указанных в частных статьях.
Если 1 или 2 образца не распались за нормативное время, это испытание повторяют на оставшихся 12 образцах. Не менее 16 из 18 образцов должны распасться полностью.
Время распадаемости должно быть указано в соответствующем разделе частной статьи. При отсутствии этих указаний таблетки без оболочки должны распадаться в течение не более 15 минут, таблетки, покрытые оболочкой, - не более 30 минут.
Кишечнорастворимые таблетки не должны распадаться в течение 1 часа в растворе 0,1 М кислоты хлористоводородной, а после промывания водой должны распадаться в растворе натрия гидрокарбоната (рН 7,5-8,0 ) в течение 1 часа, если нет других указаний в частной статье.
При отсутствии лабораторного идентификатора процесса распадаемости этот показатель можно определить в соответствии с рекомендациями ГФ Х изд.
Таблетку помещают в коническую колбу вместимостью 100 мл, прибавляют 50 мл воды, имеющей температуру 37±2 0С. Колбу покачивают 1-2 раза в секунду. Оценку распадаемости производят на основании не менее 3 определений. Таблетки считают распавшимися, если все взятые для испытания таблетки растворились или превратились в порошок, или распались на части, или превратились в рыхлую массу, которая разрушается при легком прикосновении стеклянной палочкой.
Заключение о качестве таблеток по показателю «Распадаемость» сделать на основании полученных результатов в соответствии с требованиями нормативной документации.
Приложение 3
ПРОТОКОЛ ИСПЫТАНИЙ №__
от «____» ___________г.
Лекарственное средство:
Серия: _______
Предприятие-изготовитель, страна:
Заказчик:
Нормативный документ:
Код образца:
| Наименование показателей качества по НД | Требования к качеству по нормативному документу | Результаты анализа |
| Описание | ||
| Подлинность | ||
| Количественное определение: | ||
| Упаковка | ||
| Маркировка | ||
| Хранение | ||
| Срок годности |
ПРЕДСТАВЛЕНЫЙ ОБРАЗЕЦ ПРЕПАРАТА СООТВЕТСТВУЕТ (НЕ СООТВЕТСТВУЕТ) ТРЕБОВАНИЯМ НОРМАТИВНОГО ДОКУМЕНТА ПО ПРОВЕРЕННЫМ ПОКАЗАТЕЛЯМ КАЧЕСТВА
Провизор-аналитик _____________________________
Руководитель лаборатории _____________________________
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 216; Нарушение авторских прав?; Мы поможем в написании вашей работы!