
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Види клонування
Залежно від типу клітин-донорів генетичного матеріалу можна умовно виділити декілька типів клонування. Якщо донорами ядер є ранні зародки, то ми маємо так зване ембріональне клонування. До ембріонального клонування можна віднести і таке, коли донорами ядер є ембріональні стовбурні клітини (ЕСК), але цей тип відрізняється від першого можливістю маніпулювати великою кількістю клітин, які, крім того, можна розмножувати шляхом культивування поза організмом.
Клонування ембріонів шляхом пересадження ядра має три основних етапи: отримання клітин-реципієнтів, виділення інтактного ядра донора, пересадження ядра в енуклейовану яйцеклітину. На відміну від амфібій пересадження ядра в ссавців не стимулює ооцит. Тому потрібно четвертий етап - активація ооциту і злиття мембран яйця й ооциту. Під дією електричного імпульсу відбувається активація ооциту і злиття мембран між ядром клітини донора і енуклейованим ооцитом-реципієнтом. Технологія пересадження ядер клітини сприяла успішному одержанню клонованих живих кроликів, мишей, овець, кіз, великої рогатої худоби і свиней.
Отримання клітин-реципієнтів − це один із перших етапів цієї методики. Як клітин-реципієнтів використовують або зрілі ооцити на стадії метафази II, тобто яйцеклітини, або зиготи. На початку досліджень з клонування тварин клітинами-реципієнтами були одержані іп vivo яйцеклітини, зиготи або двоклітинні ембріони. Нині при цьому використовують ооцити, що дозрівають в умовах іп vitro. Вибір клітин-реципієнтів є досить суттєвим моментом клонування, тож слід враховувати фізіологічні процеси, що відбуваються під час клітинного циклу. Внаслідок проведених експериментальних робіт та аналізу клітинного циклу встановлено, що для отримання клітин-реципієнтів ядер краще використовувати яйцеклітини, ніж зиготи. Для їх отримання потрібно менше часу, менше препаратів і реактивів. Крім того, через непрозорість цитоплазми зигот великої рогатої худоби виникає необхідність центрифугувати зародки, а це зменшує їх життєздатність. До того ж, виходячи з гіпотези про ремоделюючі/репрограмуючі фактори, цитоплазма яйцеклітин здатна репрограмувати дію ядра клітини-донора, а цитоплазма зиготи − ні.
Технологія отримання клітин-реципієнтів полягає в тому, що після розрізу скляною голкою прозорої оболонки дозрілих до метафази IIнезапліднених яйцеклітин у частині полярного тільця, ооцити приєднували до розчину РВ8, що містить 5 мкг/мл цитохалазину В. Приблизно за годину з експозиції в середовищі з цитохалазином В полярне тільце з прилеглою ділянкою ооплазми видаляли всмоктуванням за допомогою піпетки для мікроманіпуляцій. Ефективним способом елімінації (вилучення) ядерних структур дозрілих іп vitro ооцитів корів може стати також хімічна енуклеація.
Перші досліди з мікроманіпуляцій показали, що безпосереднє введення піпетки з пронуклеусом або ядром бластомера, що міститься в ній, в ооплазму зиготи або яйцеклітини ссавців викликає незворотні ушкодження плазматичної мембрани реконструйованої зиготи та її загибель через великі розміри ін'єкційної піпетки.
Для полегшення введення бластомерів у перивителиновий простір ооцитів жіночі гамети дозволяється попередньо поміщати до гіпертонічного середовища. Пересадження ізольованих поодиноких бластомерів 8-, 16- і 32-клітинних ембріонів кроля в енуклейовані ооцити, поміщені за 2...З хвилини перед мікроманіпуляціями в 0,5 М розчину сахарози в розчині РВ8, і наступне електрозлиття привели до розвитку 22,18 і 15% реконструйованих яйцеклітин відповідно до стадії морули-бластоцисти.
Уведення ядра або пронуклеусу під прозору оболонку в перивителиновий простір, як правило, не призводить до злиття каріопласту з плазматичною мембраною яйцеклітини або зиготи без застосування спеціальних фузогенів − інактивованого вірусу Сендай, поліетиленгликолю (ПЕГ) або електричного струму. ПЕР широко використовується за роботи з рослинними і соматичними клітинами, однак, у дослідженнях на ембріонах звичайно не застосовується через варіабельність активності, сильно вираженої токсичної дії на клітини, складність його видалення з плазматичної мембрани, що викликає лізис клітин і перешкоджає розвитку ембріонів. Більш вдалим у цьому відношенні є вірус Сендай. Але і він має ряд недоліків, що обмежують його застосування за роботи з ембріонами. До них відносяться ризик збереження вірулентності вірусних часток, варіабельність властивостей різних партій, низька, на відміну від його використання за злиття каріопластів яйцеклітин і бластомерів ранніх ембріонів, ефективність для клітин більш пізніх ембріонів. Крім того, бластомери ембріона отримані злиттям каріопласта з яйцеклітиною, вже не можуть бути використані як донори ядер, оскільки повторне застосування цього фузогена неможливе внаслідок втрати клітинних рецепторів, що відповідають за зв'язування з вірусом. Найбільш ефективним фузогеном для ембріонів ссавців є електричний струм. За його допомогою можливо здійснюючі серійні пересадження ядер, установлювати стабільні, але легко заміняємі залежно від бажання експериментатора параметри електричного впливу − силу струму, тривалість впливу і число імпульсів.
Частота злиття ізольованих бластомерів великої рогатої худоби з енуклейованими ооцитами корів залежить від стадії розвитку ембріона. Показник злиття був вірогідно вищим у тому разі, коли для пересадження ядер використовували 16- і 32-клітинні ембріони порівняно з ембріонами на стадії 2-х і 4-х клітин (28,9; 25,0; 4,6 і 9,7%, відповідно). Установлено, що на ефективність злиття клітинних систем і розвиток ембріонів великої рогатої худоби до морули-бластоцисти впливає вік яйцеклітини-реципієнта − частота формування реконструйованих бластоцист була значно вищою за злиття бластомерів 5,5-денних морул з енуклейованими ооцитами, що культивувалися іп vitro протягом 36 годин, ніж протягом 28, 32 і 40 годин. Продемонстровано можливість використання як джерела ядер 16...48-клітинних морул великої рогатої худоби, отриманих іпvivo ідалі кріоконсервованих, а також морул, отриманих іп vitro. Частота злиття, дроблення і формування бластоцист для свіжих ембріонів, отриманих іпvivo, заморожено-відтаяних ембріонів, отриманих іпvivo, і ембріонів, отриманих іп vitro, становила 80,0; 75,4 і 30,2%; 74,0; 64,9 і 7,1%; 84,5; 70,7 і 22,6%, відповідно.
Додатковим джерелом ядер можуть стати ембріональні стовбурні клітини (ЕС-клітини). Вирішення цієї проблеми дозволить, як очікується, одержувати велику кількість ідентичних нащадків.
ЕС-клітини мають нормальний каріотип, лінії цих клітин можна зберігати в недиференційованому стані в культурі від 3-х місяців до року, заморожувати івідтаювати кілька разів без істотного зниження їх здатності до розвитку. Іншою перевагою ЕС-клітини є те, що вони можуть бути отримані від ліній тварин, що несуть рецесивні летальні мутації або від партеногенетичних ембріонів. ЕС-клітини не диференційовані і після утворення химерних ембріонів з них і звичайних морул або бластоцист можуть брати участь у формуванні різних органів, у тому числі клітин зародкової лінії. Оскільки ЕС-клітини можна генетично трансформувати, з їх допомогою можливе створення трансгенних тварин. ЕС-клітини можуть, імовірно, формувати повноцінний ембріон. Нещодавно проведені на мишах експерименти підтвердили це припущення, показавши принципову можливість злиття ЕС-клітин з енуклейованими ооцитами і одержання реконструйованих ембріонів.
Пересадження ядер ембріональних стовбурних клітин, отриманих від ВКМ (внутрішньоклітинна маса) бластоцист і морул великої рогатої худоби, шляхом електрозлиття ЕС-клітини (діаметр стовбурних клітин дорівнює 15...22 мкм) з енуклейованими ооцитами корів, що дозріли іп vitro, дозволило одержати клони ембріонів на стадії бластоцисти, пересадження яких реципієнтам призвело до одержання трьох 38..<45-денних плодів. Не було встановлено змін морфологічних характеристик ЕС-клітини протягом понад 12-місячного культивування клітин іп vitro; показана здатність ліній ЕС-клітини до спонтанного диференціювання в ембріоїдні тіла і ендодермоподібні клітини.
Великий інтерес викликають повідомлення К. Кемпбелла зі співавторами про одержання 5-ти живих ягнят шляхом злиття поодиноких клітин ембріонального диска (ЕД-клітини) 9-денних ембріонів овець з енуклейованими дозрілими до метафази II ооцитами, при цьому клітинні лінії ЕД-клітин залишалися тотипотентними, принаймні, протягом 3 пасажів.
Принципово вищим ступенем клонування є так зване соматичне клонування, коли донорами ядер є соматичні клітини дорослого організму. Якщо в перших двох типах клонування можливо отримати копії ембріона і невідомо, які властивості матимуть тварини з цих зародків, то в останньому – копіюєтьсяіснуючий дорослий організм. Отримання генетичних копій тварин відкриває неймовірні перспективи як для науки, так і для виробництва, але й реалізація соматичного клонування набагато складніша. Це викликано ступенем диференціації генетичного матеріалу клітин, що є донорами ядер для пересадок. Якщо на ранніх стадіях розвитку ембріону (2... 4 клітини) всі бластомери є тотипотентними і кожен з них може дати початок новому зародку, то на більш пізніх стадіях ембріогенезу це вже неможливо. Ядра 8-...32-клітинних зародків уже диференційовані, але ступінь їх спеціалізації ще не високий, і вони здатні активізуватися в цитоплазмі енуклейованої яйцеклітини, а створений ядерно-цитоплазматичний гібрид спроможний розвинутися в повноцінний зародок. Більш високий ступінь диференціації ембріональних стовбурних клітин, які отримують з внутрішньоклітинної маси бластоцисти, робить завдання реконструювання ембріону з їх ядер ще важчою. Набагато складніше завдання активізувати ядра глибоко диференційованих соматичних клітин. Теоретично це можливо тільки в тому разі, якщо соматична клітина буде на певній стадії мітозу − коли вона не виконує відповідні функції в організмі, а розмножується, тобто певною мірою схожа на ембріональну клітину.
У лютому 1997 року з'явилося повідомлення, що в лабораторії Яна Уілмута в Рослинському інституті (Единбург, Шотландія) розробили ефективний метод клонування ссавців і на основі його використання вивели ягня Доллі. Насамперед, необхідно було виділити ооцити (яйцеклітини). їх витягли з овець породи шотландська чорноморда, помістили у штучне поживне середовище із додаванням ембріональної телячої сироватки за температури 37°С и провели операцію енуклеації (видалення власного ядра). Після цього виникнула потреба забезпечення яйцеклітини генетичною інформацією від організму, який належало клонувати. Для цієї мети використали різні клітини донора, але найбільш зручними виявилися диплощні клітини молочної залози дорослої вагітної вівці. Ці клітини виводили зі стадії росту клітинного циклу, розбавляючи сироватку, і через п'ять днів з'єднували з енуклеїованим ооцитом. Останній потім активували до розвитку за допомогою електричного удару. Зародок, що розвивається, культивували протягом 6-ти днів у штучному хімічному середовищі або яйцепроводі вівці, перетягненому лігатурою ближче до рога матки. На стадії морули або бластоцисти ембріони (від одного до трьох) трансплантували в матку прийомноїматері, де вони могли розвиватися до народження (рис. 60).
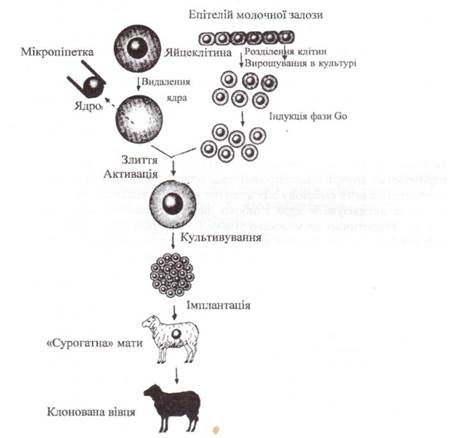
|
З 236 дослідів успіх мав лише однин, внаслідок чого і народилося ягня Доллі, яке містить генетичний матеріал дорослої вівці, що вмерла три роки тому. Точними молекулярно-генетичними дослідженнями було доведено, що Доллі є клонованою твариною.
Особливий інтерес викликають досліди групи вчених з університету в Гонолулу на чолі з Ріузо Янагімачі. Авторам удалося вдосконалити метод Уілмута, вони відмовилися від електричної стимуляції злиття донорської соматичної клітини з яйцеклітиною йвинайшли таку мікропіпетку, за допомогою якої можливо було безболісно витягувати ядро із соматичної клітини й трансплантувати його в яйцеклітину, що позбавлена власного ядра. Крім того, автори використали як донорські ядра відносно менш диференційованих клітин, що оточують ооцит. Нарешті, вдалося синхронізувати процеси, що протікають у яйцеклітині й ядрі, що трансплантується в неї. Це дозволило забезпечити природні ядерно-цитоплазматичні взаємини між ядром і цитоплазмою, оскільки ядро, що трансплантується і диференційоване в певному напрямку, та цитоплазма яйцеклітини до того працювали ніби в різних режимах.
Автори використали для трансплантації ядра клітин, що оточують ооцит (клітин так називаного cumulusoophorus), клітин Сертоли з сім'яників і клітин, виділених з мозку - нейронів. Ядра, виділені із соматичних клітин, ін'єстували в енуклейоване яйце за допомогою мікропіпетки. Яйце активували до розвитку, помістивши в спеціальний розчин (так званий НЕРЕS-СZВ), вільний від кальцію, із додаванням стронцію і цитохалазину. Стронцій активував яйце, а кальцій придушував утворення полярних тілець.
Ембріони культивували до стадії 2...8 клітин, морули або бластули й потім трансплантували в матку прийомній матері, де значна їх кількість імплантувалася і деякі (15... 16%) продовжували розвиток. Відсоток виходу народжених мишенят (їх витягували за допомогою розтину кесарева на 18,5... 19-й дні вагітності) був, однак, низький − у різних серіях експериментів від 2,0 до 2,8%. Молекулярні дослідження довели належність ядер народжених мишенят до клітин донора соматичних клітин. Таким чином, принаймні в деяких випадках було доведено здатність ядер соматичних клітин забезпечувати нормальний розвиток ссавців. Отже, одержання клону принципово можливе. Однак, це ще не означає одержання точної копії клонованої тварини. Насправді одержати абсолютно точну копію даної конкретної тварини (а саме така кінцева мета ставиться в експериментах по клонуванню) набагато складніше, ніж це здається за поверхневого знайомства із проблемою.
І справа зовсім не в технічній розробці методів клонування, а в тому, що структурно-функціональні зміни ядер у процесі індивідуального розвитку тварин досить глибокі: одні гени активно працюють, інші інактивуються й «мовчать», при цьому сам зародок являє собою своєрідну мозаїку статей розподілу таких функціонально різних генів. І чим організм більше спеціалізований, чим вищийпідйом еволюційних сходів, на яких він стоїть, тим ці зміни глибші й сутужніше оборотні. У деяких організмів, наприклад, у відомого кишкового паразита аскариди, генетичний матеріал у майбутніх зародкових клітинах, залишається незмінним під час розвитку, а в інших, соматичних клітинах викидаються цілі великі фрагменти ДНК − носія спадкоємної інформації. У червоних кров'яних клітинах (еритроцитах) птахів ядра зморщуються в маленьку грудочку й не працюють, а з еритроцитів ссавців, що стоять еволюційно вище за птицю, ядра взагалі відсутні.
Відомо, що в, соматичних клітинах у ході їхнього розвитку хромосоми послідовно коротшають на своїх кінцях, у зародкових клітинах спеціальний фермент − теломераза добудовує, відновлює їх, тобто отримані дані знов-таки свідчать про істотні розходження між зародковими і соматичними клітинами. І отже, постає питання, чи здатні ядра соматичних клітин повністю й еквівалентно замінити ядра зародкових клітин у їхній функції забезпечення нормального розвитку зародка.
У жаби, як істоти гірше розвиненої, ніж ссавці, ядерні зміни менше виражені. І при цьому відсоток успіху за клонування, як уже відзначали, невисокий (1...2%), а крім того, навіть ті жаби, які досягають у дослідах з клонування дорослого стану, - не без дефектів, отже, про точне копіювання донора, на жаль, важко говорити навіть у цьому найпростішому випадку. Але ссавці значно складніші, ніж жаби за власною організацією й ступенем диференціації клітин. Природно, у них відсоток успіху буде, принаймні, не вище (про що й свідчать результати дослідів Р. Янагімачі). Виникає проблема – як повернути ядра соматичних клітин, що змінилися, до вихідного стану, щоб вони могли забезпечити нормальний розвиток тієї яйцеклітини, у яку їх трансплантували. Успіх буде залежати від того, чи вдалося знайти таку соматичну клітину (із числа так званих камбіальних, від лат. сатbіит обмін; клітини, що подвоюються), ядро якої ще не втратило свого потенціалу, і так, щоб ще й не ушкодити це ядро в процесі складних хірургічних маніпуляцій. Крім того, умови розвитку в матці різних прийомних матерів будуть розрізнятися, а існує таке поняття, як норма реакції, тобто певні межі коливань прояву даного гена у фенотовій ознаці. Це значить, що в різних умовах розвитку зародка однакові гени будуть виявляти свою дію по-різному. Але ж таких генів тисячі. Отже, імовірність повної подібності клонованих тваринбуде не дуже велика.
Таким чином, у наш час можливо розглядати як науковий напрямок з певними досягненнями тільки клонування ембріональне. І хоча з загальнобіологічної точки зору соматичне і ембріональне клонування суттєво відрізняються, з погляду на використання цього методу в народному господарстві, зокрема в тваринництві чи фармацевтичній промисловості, різниця між ними може бути невеликою. Це можливо за рахунок використання біотехнології, в якій комбінуються клонування як метод розмноження організмів і кріоконсервація як метод введення останніх в анабіоз. Запропонована біотехнологія дозволяє і у разі використання ембріонального клонування передбачати ознаки нащадків за рахунок того, що поки більшість ембріонів клону зберігається в замороженому вигляді − у скрапленому азоті, 1...2 з них пересаджуються реципієнтам і перевіряються за якістю нащадків. Для повторного розмноження і отримання чисельних нащадків використовуються тільки ембріони тих клонів, що мають необхідні господарсько-корисні ознаки. За кількісними та якісними показниками ембріональне клонування наближається до соматичного саме при повторному (багаторазовому) розмноженні зародків, коли клоновані ембріони попереднього покоління є донорами ядер для наступного циклу реконструкції. У цьому разі кількість зародків зростає в геометричній прогресії, а ефективність реалізації біотехнології отримання нащадків з прогнозованими ознаками наближається до значень, що задовольняють практиків.
Незважаючи на те, що величезні потенційні можливості методу клонування привернули увагу багатьох провідних учених сучасності, що в розвинутих країнах виділяються великі кошти на дослідження в біотехнології тварин як у межах бюджетних асигнувань на науку, так і приватним капіталом, успіхи залишаються поки що незначними. їх можна оцінити як такі, що показали принципову можливість клонування вищих тварин, але до розробки технологічного процесу, що давав би стабільні та задовільні за економічними показниками результати, ще далеко (табл. 9).
Статистика свідчить, що вихід потомства від кількості проведених ядерних пересадок вкрай низький і для головних видів сільськогосподарських тварин становить: у свиней − 1%, у великої рогатої худоби коливається від 1% до 4%, у овець − 4%.
Таблиця 9
|
|
Дата добавления: 2017-02-01; Просмотров: 230; Нарушение авторских прав?; Мы поможем в написании вашей работы!