
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Створення партеногенетичних тварин
|
|
|
|
Під партеногенезом розуміють розвиток ембріона з жіночої гамети без участі чоловічої статевої клітини, тобто партеногенетичні особини в хромосомах містять тільки гени матері. Таким чином, партеногенез приймає форму безстатевого розмноження у тварин зі статевим способом відтворення.
У біології розмноження тварин розмежовують два різновиди партеногенезу − гіногенез і андрогенез. При гіногенезі спермії проникають в яйцеклітину, але її функція полягає лише в активації яйцеклітини, а ембріон розвивається без участі хромосом спермія. Однак, при гіногенезі спермії можуть внести в ядро яйцеклітинипозахромосомні, у тому числі й спадкоємні фактори, що здатні брати участь в індивідуальному розвитку тварини.
При андрогенезі, на відміну від справжнього партеногенезу, після активації жіночої гамети спермієм весь генетичний матеріал заплідненої яйцеклітини елімінується, і тому ембріон містить лише батьківський набір хромосом. У цьому разі зигота, а потім і ембріон, розвиваються тільки за участю набору хромосом чоловічого ядра (рис. 63).

Рис. 63. Схема отримання різних типів партеногенетичних тварин
У сучасній науковій літературі тварин, отриманих за рахунок партеногенезу, називають партеногенами.
Розрізняють диплоїдну і гаплоїдну форми партеногенезу. За диплоїдного партеногенезу мейоз (тобто редукції числа хромосом) не відбувається, або диплоїдний набір хромосом відновлюється. Відомі два механізми диплоїзації партеногенезу: амейотичний і мейотичний.
За амейотичного партеногенезу активація яйцеклітин до партеногенезу відбувається на метафазі першого розподілу. Під впливом незвичайних умов на цій стадії мейозу яйцеклітини повністю придушується редукційний розподіл хромосом, потім відбувається другий − екваційний розподіл мейозу розподіл сестринних хроматидів.
|
|
|
У результаті таких процесів формується яйцеклітина з диплоїдним жіночим пронуклеусом. З таких яйцеклітин можуть розвиватися диплоїдні ембріони винятково жіночої статі. Хоча слід мати на увазі, що в ссавців, в тому числі й сільськогосподарських тварин, амейотичний партеногенез невідомий. Однак, при штучному придушенні мейозу є можливість одержання амейотичного партеногенезу, за допомогою якого весь набір генів (за відсутності кросинговеру, або перехрестя хромосом) матері може бути переданий нащадкам.
За мейотичного партеногенезу мейоз протікає нормально, тобто завершуються обидва розподіли з утворенням жіночого пронуклеусу. Останній поділяється на два гаплоїдні дочірні ядра, які об'єднуються в одне диплоїдне ядро, що забезпечує партеногенетичний розвиток ембріона, а потім і особини по материнській лінії.
У 1886 р. російський біолог А.А. Тихомиров відкрив явище штучного партеногенезу шовковичного шовкопряда. Уперше він експериментально довів, що незапліднена яйцеклітина шовковичного шовкопряда може бути активована до розвитку штучними стимулами, зокрема, розрідженою сірчаною кислотою. Це відкриття стало початком вивчення проблеми партеногенезу. Шовкопряд виявився найбільш придатним об'єктом для вивчення і практичного використання партеногенезу. Б.Л. Астауровим і В.А. Струнниковим було отримано різні варіанти партеногенетичних порід та ліній шовкопряда. Результати цих робіт викликають не тільки великий теоретичний інтерес, а й мають фактичне застосування в промисловому шовківництві.
Природний партеногенез. Природний партеногенез найпоширеніший у комах − палочників, жуків-довгоносиків, а також у ракоподібних і коловерток. Його виявлено також у бджіл (трутні),ос, скельної ящірки, а серед свійських тварин − у індичок. Було помічено, що із незапліднених яєць белтсвилських дрібних білих індичок у деяких випадках (1...4%) можуть розвиватися ембріони. Селекція на підвищення частоти природного партеногенезу виявилася ефективною. У результаті цілеспрямованої селекції частка партеногенетичних яєць, що розвиваються, досягла 42%. Було помічено, що за відсутності відбору лише в поодиноких випадках партеногенетичний розвиток проходить до вилуплення пташенят-партеногенів. За здійснення селекції відсоток ембріонів, що розвиваються до пізніх стадій інкубації, зростає.
|
|
|
Слід зазначити, що всі партеногенетичні ембріони й індиченята, що сформувалися з них, були самцями. Цитогенетичний аналіз показав, що партеногени мали дишюїдний набір хромосом.
З погляду генетики одержання партеногенетичних самців можна пояснити таким чином. В індичок жіноча стать гетерогаметна (ZW). Тому самка має половину ооцитів з Z-статевою хромосомою, а половину − з W-статевою хромосомою. При партеногенетичному розвитку яєць відбувається злиття хромосом в ооцитах з Z-хромосомою, що призводить до утворення зиготи ZZ, з якої і утворюються життєздатні самці з нормальним для них набором статевих хромосом. При подвоєнні хромосом типу W утворюються зиготи, а потім і ембріони з набором хромосом WW, тобто позбавлені Z-хромосоми. Такі особини є нежиттєздатними. Слід підкреслити роль селекції в створенні партеногенетичних тварин і ліній. У згаданій породі індичок у результаті партеногенетичного розвитку із заплідненого яйця було отримано диплоїдного індика, який став батьком 122 нормальних індичат. Однак спонтанний партеногенез є лише винятком у розмноженні тварин. Навіть у наведеному прикладі з індиками природний партеногенез не можна розглядати як нормальний статевий процес.
Штучний партеногенез. На базі сучасної біотехнології можуть бути розроблені ефективні методи, що викликають штучний партеногенез шляхом стимуляції партеногенетичного розвитку яйцеклітини. Найбільший інтерес викликає індукований партеногенез у ссавців. Однак, у цього класу тварин це пов'язано з великими труднощами через особливості оогенезу. Справа в тому, що у ссавців, як правило, яйцеклітини овулюють на стадії метафази II. Тому партеногенетичному розвитку можуть бути піддані лише зрілі ооцити. Лише у 70-і роки, з розробкою методів культивування й запліднення фолікулярних ооцитів іп vitro, почалися широкі дослідження стимуляції партеногенезу в ссавців, у тому числі у великої рогатої худоби. Як стимулятори, що викликають партеногенетичний розвиток яйцеклітини, використовують механічні, фізичні, хімічні й біологічні фактори.
|
|
|
Активація ооцитів тварин призводить до різних шляхів партеногенетичного розвитку (рис. 64). Наведемо деякі приклади:
1. Завершення другого мейотичного поділу може призвести до виділення одного гаплоїдного набору хромосом у вигляді полярного тільця і формування єдиного пронуклеуса з іншого. Потім у гаплоїдному пронуклеусі відбувається реплікація ДНК, і яйцеклітина поділяється на два бластомери з гаплоїдними наборами хромосом. Ці зародки називають генетично однорідними гаплоїдами, тому що їх гомологічні хромосоми генетично ідентичні;
2. Ооцит, завершивши перший розподіл дозрівання, замість утворення другого полярного тільця (тобто минаючи другий мейотичний розподіл), вступає в дроблення − поділяється на дві однакові за розмірами гаплоїдні клітини, у кожній з яких формується пронуклеус (негайне дроблення). Внаслідок того, що розподіл відбувається після кросинговеру і обидва гаплоїдних набори не є генетично ідентичними, зародки називають мозаїчними гаплоїдами;
3. Після метафази другого розподілу дозрівання і розбіжності хромосом цитотомія не здійснюється (друге полярне тільце не виділяється), внаслідок чого відбувається формування двох гаплоїдних пронуклеусів. Після цього в одних випадках ооцит поділяється на два бластомери -мозаїчний гаплоїд, а в інших, після реплікації ДНК, формування метафазної пластинки і розподілу дроблення, розвивається гетерозиготний партеногенетичний диплоїд (гетерозиготність обумовлена кросинго-вером);
4. Ооцит не проходить другого розподілу дозрівання і хромосомиформують один великий диплоідний пронуклеус. Післяреплікації ДНК і наступного дроблення утворюютьсягетерозиготний (наслідок кросинговера) партеногенетичнийдиплоїд;
|
|
|
5. Відбувається нормальний мейоз із двома розподілами, післячого гаплоїдний набір хромосом яйцеклітини формує єдинийпронуклеус, який після подвоєння свого хромосомного набору поділяється на два гаплоїдних ядра. Ці ядра зливаються, утворюють одне диплоїдне ядро, розвивається гомозиготний диплоїд. Різновидом цього шляху розвитку, що властивий шовковичному шовкопрядові, є утворення диплоїдного пронуклеуса в яйцеклітині ссавця після мікрохірургічного видалення чоловічого пронуклеуса і штучної диплоїдизації жіночого пронуклеуса зиготи, що залишився;
6.. Цілком придушується редукційний розподіл або виділення першого полярного тільця (в останньому випадку хромосоми полярного тільця поєднуються з хромосомами ооциту). Далі відбувається розподіл, що призводить до розбіжності сестринних хроматид. Внаслідок цього в шовковичного шовкопряда утворюються два генетично ідентичних диплоїдних пронуклеуси (у деяких представників гетерогаметної статі), з одним із яких пов'язаний подальший розвиток: після реплікації ДНК яйцеклітина поділяється на два бластомери, кожний з яких містить диплоїдний набір хромосом. Розвивається гетерозиготний партеногенетичний диплоїд, генотип якого ідентичний генотипові матері (амейотичний партеногенез). Крім названих шляхів розвитку стимульованих до партеногенезу ооцитів є й інші. Так, у деяких яйцеклітин утворюється три пронуклеуси, може мати місце тетраплоїдний партеногенез, гаплоїдний зародок може перетворюватися в гаплодиплоїдний та ін.
Одержання того або іншого типу партеногену обумовлене стадією оогенезу, на якій здійснюється активація ооцита, типом активуючого фактора, інтенсивністю впливу і тим поживним середовищем, у якому культивувалися яйцеклітини після активації.
Змінюючи ці фактори, можна спрямувати отримання партеногену того або іншого типу.
У більшості випадків, як показали дослідження, за оптимальних умовах активації розвивається один тип партеногенів − однорідні гаплоїди, тобто яйцеклітини, що виділили після активації друге полярне тільце і мають один гаплоїдний пронуклеус. У такому гаплоїдному пронуклеусі здійснюється редуплікація ДНК і яйцеклітина розподіляється на два бластомери з гаплоїдним набором гомологічних хромосом. Інакше кажучи, цей шлях партеногенетичного розвитку яйцеклітин дозволяє отримати гомозиготних особин протягом одного покоління.

Рис. 6 4. Шляхи партеногенетичного розвитку з урахуванням трьох перемінних: першого та другогополярного тільця і першого дроблення (заВеайу, 1957)
Посилення інтенсивності впливу факторів, що активують, призводить до збільшення частоти мозаїчних гаплоїдів і обох типів диплоїдних партеногенетичних зародків.
У наш час випробувано багато агентів, здатних активувати яйцеклітини ссавців до партеногенетичного розвитку. Як стимулятори використовують механічні впливи, тепловий, електричний або осмотичний шок, ферменти (гіалуронідаза, трипсин, проназа), двовалентні катіони, антисептики (етанол, дибукаїн, тетракаїн, лигнокаїн, прокаїн), фенотіазинові транквілізатори, інгибітори синтезу білків.
Стимуляція електричним або температурним шоком є найбільш ефективною як іп vitro, так і іп vivo. Електричний струм активує до партеногенезу близько 3/4 свіжоовульованих яйцеклітин, 90% з яких досягає стадії морули або бластоцисти. Температурні впливи стимулюють до 90... 100% яйцеклітин. При застосуванні осмотичного шоку активованих яйцеклітин було значно менше − 38...58%.
Є передумови одержання партеногенів і на більш ранніх стадіях стимуляції яйцеклітини ссавців. Цей підхід можливий в умовах культивування ооцитів іп vitro. Виділені з яєчників ооцити можна культивувати до стадій метафази І і метафази II, після чого їх стимулюють до партеногенетичного розвитку з наступним культивуванням і трансплантацією реципієнтам.
Ооцити, що є на різних стадіях мейотичного дозрівання, стимулювалися до партеногенетичного розвитку холодовим шоком за температури 0...4°С протягом 15...36 хв. Потім клітини прогрівали протягом 5 хв. за температури 37,5°С у звичайному середовищі культивування. Після прогрівання ооцити культивувалися у звичайних середовищах. Тривалість культивування ооцитів і зародків -69... 73 год.
Ознаками партеногенетичного розвитку були: виділення полярного тільця, утворення пронуклеусів, синкаріону, першої метафазної пластинки мітозу, дроблення клітин. Результати проведених досліджень показали, що при стимуляції ооцитів до партеногенезу на різних стадіях мейозу найвищий ефект спостерігається за їх активування на метафазі II.
Частка активованих до партеногенетичного розвитку ооцитів, що оцінювалась за виділенням другого напрямного тільця, утворенням пронуклеусів і проходженням першого розподілу дроблення, становила 56,4%. Цитогенетичний аналіз виявив наявність ядер у бластомерах. Цікавим було те, що холодовий шок на стадії метафази IIпризводив до мейотичного, а на метафазі І як до мейотичного, так і до амейотичного партеногенезу.
У великої рогатої худоби мейотичний партеногенез дозволить отримати майже повністю гомозиготних нащадків. За амейотичного партеногенезу, коли активування ооцитів до розвитку відбувається на метафазі І, є можливість майже повністю повторити генотип матері вїї нащадках.
Короткочасний вплив на свіжоовульовані ооцити миші 7-процентним розчином етилового спирту протягом 1, 3 і 5 хвилин викликає однаково високу частоту партеногенетичної активації -64,6; 69,5 і 63,7%, відповідно.
У дослідах виявлена чітка залежність інтенсивності дії етанолу від його концентрації і температури середовища під час активації. Показано, що максимальне число яйцеклітин активується 4-процентним етанолом за температури 33,2°С, а при 7-процентній його концентрації активізуючий вплив найбільш повно виражений за температури 24,5°С. Після трансплантації активованих яйцеклітин реципієнтам зародки до 72...96год.досягали стадії морул ібластоцист.
Найбільший інтерес викликає застосування біологічних факторів, оскільки їх дія може зберігатися і у наступних поколіннях. Ефект інфікування курей та індичок вірусом саркоми Рауса або вірусом віспи птиці зберігається протягом двох поколінь і виявляється в збільшенні до 25% числа знесених яєць, здатних до партеногенетичного розвитку. Для викликання партеногенетичного активування дозрілих іп vitro ооцитів великої рогатої худоби також використовують біологічні методи (віруси саркоми Рауса й віспи птиці, запліднення сперматозоїдами інших видів ссавців).
Досліди на мишах показали, що партеногенетичні зародки здатні у своєму ранньому ембріональному розвитку завершити передімплантаційну стадію, тобто утворити бластоцисти. Однак, партеногенетичні бластоцисти здебільшого не можуть імплантуватися або гинуть на початкових стадіях постімплантаційного періоду.
Шляхом аналізу динаміки розвитку партеногенетичних зародків було виявлено, що вже на самих ранніх стадіях ембріогенезу партеногени розвиваються слабкіше за запліднені яйцеклітини. Ця різниця зростає і далі аж до імплантації. Причому така закономірність характерна для всіх типів партеногенетичних зародків. Однак, слід зазначити, що диплоїдні иартеногенетичні зародки розвиваються краще і гинуть пізніше гаплоїдних. Морфологічні і гістологічні дослідження показали, що паргеногенетичні, особливо гаплоїдні бластоцисти, нерідко відрізняються значними відхиленнями від норми. Це негативно позначається не тільки на розвитку партеногенетичних зародків, а й на результатах їхньої імплантації.
Дотепер механізм загибелі партеногенетичних зародків у ссавців не з'ясований. Висловлено припущення, що загибель викликана порушенням темпів дроблення, формуванням неповноцінних бластоцист, десинхронізацією процесів, що протікають у стінці слизової матки та в трофоектодермі при введенні зародка в слизову матки.
А.П. Дибан і Е.М. Ноніашвілі (1986) припускають, що загибель партеногенетичних зародків мишей може бути викликана нестабільністю їхнього каріотипу, появою хромосомних аберацій, а також обумовлюватися рецесивними летальними мутаціями, ефект яких проявляється в гемізиготному стані алелів у гаплоїдів. Ці ж автори, узагальнивши великий літературний матеріал, указують на дві основні гіпотези загибелі постімплантаційних партеногенетичних зародків.
Відповідно до першої − за активації яйцеклітини до партено-генетичного розвитку її цитоплазма стає неповноцінною.
На підставі останніх експериментів і теоретичного аналізу отриманих результатів була сформульована друга гіпотеза, що має все більше визнання. Останнім часом у дослідах з реципрокними пересадженнями пронуклеусів між зиготами миші було показано, що у ссавців для завершення ембріогенезу необхідні як чоловічий, так і жіночий пронуклеуси.
Класичні досліди М. Сурані зі співавторами, проведені на мишах, показали, що ні подвійна доза материнських генів (партеногенетичні ембріони), ні подвійна доза батьківських генів (андрогенетичні ембріони), ні наявність у ембріонів дишюїдних одноматеринських і однобатьківських клітин недостатні для нормального ембріонального розвитку, що для завершення ембріогенезу клітина повинна мати і материнські, і батьківські хромосоми.
Було показано, що чоловічий геном необхідний для утворення позазародкових тканин, а жіночий − для проходження визначенихстадій ембріогенезу. В роботі, проведеної також на мишах, показано, що чоловічий геном необхідний для розвитку трофектодерми (ТЕ) і надалі − плаценти, але до 8-клітинної стадії участь батьківського генома в повноцінному розвитку мишачих ембріонів не обов'язкова. Гаплоїдний набір недостатній для проліферації клітин, тому виживають тільки диплоїдизовані клітини. Нормальний розвиток ембріонів можливий лише в тому випадку, якщо бластоцисти містять як клітини внутрішньої клітинної маси (ВКМ), так і клітини трофектодерми. Це пояснюється тим, що клітини ВКМ і ТЕ відрізняються низкою властивостей. Клітини ТЕ під індукційним впливом ВКМ проліферують і з них утворюються позазародкові тканини, коли клітини ВКМ не утворюють зародкових оболонок, а формують тіло зародка, тобто його тканини і органи.
Незважаючи на проведені дослідження, механізм партеногенетичного розвитку у великої рогатої худоби ще не повністю розпізнаний. Тільки остаточне вивчення механізму партеногенетичної активності ооцитів сприятиме розробці надійного методу клонування, одержання майже повністю гомозиготних нащадків (мейотичний партеногенез) або генетичних копій матері (амейотичний партеногенез). За допомогою клонування можливо буде прискореними темпами створити генетичні лінії в племінному скотарстві і популяції ідентичних особин з необхідними генотипами для ефективного виробництва молока і м'яса в промисловому скотарстві.
Дуже важливим за клонування тварин є амейотичний партеногенез, що дозволяє практично без змін повторювати цінний генотип матері в її потомстві. Можливість одержання тільки жіночих особин, наприклад, у великої рогатої худоби, що в поєднанні із кращими продуктивними якостями, як повторюються в наступних поколіннях, значно спрощує селекцію. Комплексне використання методів партеногенетичного розвитку яйцеклітин і їхньої трансплантації дозволяє перевести відтворення високопродуктивних тварин на промислову основу, що має велике господарське значення.
Стимуляція партеногенетичного розвитку дає можливість у перспективі одержувати величезну кількість гомозиготного або одноманітного за генотипом потомства. Це дозволить у найкоротший термін різко підвищити продуктивність тварин і одержувати особин бажаної статі. Створення черід із клонованих тварин буде сприяти розвитку промислового тваринництва. Тварин одного генотипуможна утримувати на однаковому раціоні, непотрібно здійснювати селекцію за екстер'єром, реакціями поведінки, вименем й іншими ознаками. Полегшується розробка питань машинного доїння, норм годівлі. Створений доїльний апарат для однієї корови буде придатним для всіх її генетичних аналогів.
Таким чином, створення клонів тварин можна розглядати як ефективну біотехнологію майбутнього племінного і користувального скотарства.
6.5. Створення химерних тварин (генетичних мозаїків)
Поняття химера (грец. Chimaira) – означає складена тварина. У сучасному понятті термін химера використовується головним чином за одержання складених організмів, у яких генетично різні клітинні популяції походять більше, ніж від однієї зиготи або зародка. За класифікацією К. Форда (1969), варто розрізняти первинний химерізм, коли різні клітинні популяції співіснують із моменту запліднення або раннього ембріогенезу, і вторинний, за якого комбінуються тканини від двох і більше дорослих особин або ембріонів після початку глибокої клітинної диференціації. Наприклад, у близнюків великої рогатої худоби спостерігається загальний плацентарний кровообіг і в крові можна виявити вторинний химерізм (Завертяєв Б.П., 1987). Варто відрізняти химер від спонтанно виниклих складених тварин - мозаїків, що походять з однієї заплідненої яйцеклітини.
У цей час одним з перспективних напрямків біотехнології є штучне одержання химер або генетичних мозаїків. Сутність такого біотехнічного методу, заснованого на досягненнях клітинної інженерії і мікроманіпуляцій на ранніх ембріонах, полягає в штучному об'єднанні ембріональних клітин двох і більше тварин, що належать не тільки до однієї породи, а й до різних порід і навіть видів. Отримані тварини − химери мають ознаки різних генотипів. Сучасна мікрохірургія дозволяє одержувати химер, що мають чотирьох і більше батьків.
Методи створення експериментальних химер. Усі дотепер відомі в науці експериментальні химери ссавців створені методами агрегації двох (або більше) генотипічно різнорідних зародків або шляхом мікроін'єкції клітин внутрішньоклітинної маси (ВКМ) бластоцисти донорів у бластоціль ембріона-реципієнта. Перший методдістав назву агрегаційний, другий − ін'єкційний. Схематично ці методипоказано на рис. 65.
Агрегаційний метод. Уперше агрегаційний метод одержання химерних мишей був розроблений А. Tarkowski (1961, 1963) і В. Mintz (1962).
Два ембріони, що розрізняються генотипами на стадії 8... 12 бластомерів, обробляють протеолітичним ферментом проназою, вивільняють від зони пелюциду і зближають один з одним у культуральному середовищі. З'єднані ембріони культивують протягом 24...48 год. до завершення агрегації, тобто до утворення бластоцисти. Використають середовище Бринстера в краплях модифікованого розчину Кребса − Рингера з бікарбонатом, а також інші. Отримані таким чином химерні ембріони трансплантують реципієнтній миші. Агрегаційні химери можливо одержувати не тільки між двома ембріонами, а й між різним числом ізольованих бластомерів або окремими частинами ембріонів (Мак-Ларен Е., 1979). При цьому маса химерних ембріонів буває не більше ніж у звичайних, тобто вона підлягає дії механізмів ембріональної регуляції. Перевага агрегаційного методу полягає в тому, що він не потребує втручання мікрохірургічної техніки, що дозволяє широко його використати в ембріогенетиці.
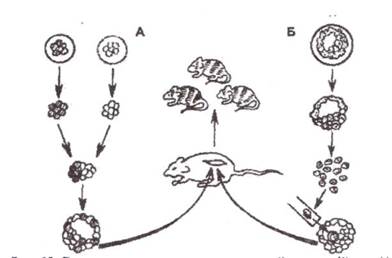
Рис65. Схема отримання химерних мишей агрегащиним (А) та ін'єкційним (Б) методами (Завертяєв Б.П., 1989)
Ін'єкційний метод. Ін'єкційний метод, що потребує застосування мікроманіпуляційної техніки й мікрохірургічного втручання, був розроблений Р. Гарднером (1968). За ін'єкційного методу використовують ембріони, що перебувають на стадії бластоцисти. Бластоцисту тримають усмоктувальною піпеткою й, використовуючи мікроманіпулятори, у трофобласті шляхом проколів голками зони пелюциду роблять отвір, через який ін'єктують ВКМ донорського зародка. Пізніше вдалося встановити, що за цим методом можливо ін'єктувати не тільки ВКМ ранніх ембріонів, а й більш диференційовані клітини. Отриману химерну бластоцисту трансплантують миші-реципієнтові.
Ін'єкційний метод знайшов застосування за одержання міжвидових химер.
Для ідентифікації химерних тварин застосовують ряд маркерів. Як маркерні використовують гени, що контролюють пігментацію, структуру шерсті, антигенні, біохімічні, морфологічні й ін. За одержання химерних тварин, що створюються від фенотипових контрастних порід або видів, широко використовують морфологічні маркери (рис. 66).

Рис. 66. Химерні миші
(за матеріалами співробітників лабораторії генетики розвитку Інституту загальної генетики РАН Мартинової М.Ю. і Ісаєва Д.А.)
Створення химерних лабораторних ссавців. Першими створеними й ідентифікованими химерами були миші між лініями агуті і неагуті (чорна). Химери виявилися крапчастими, причому агуті (кремовий колір) і чорне забарвленням, перемішуючись, формували своєрідний візерунок (Міпtz В., 1965). Надалі було показано, що в експериментальних химер, отриманих з пігментованої і непігментованої ліній, стрижні деяких шерстинок були повністю пігментовані, інші − зовсім позбавлені меланину, а треті − були плямистими. Таким чином, у забарвленні шерсті мишей проявляється дія батьківських генів з характерним різним ступенем проміжної експресії генів. Якщо химерізм стосується кількох локусів, що впливають на колір шерсті, за утворення пігменту відбуваютьсяфенотипові взаємодії.
Одержання агрегаційних внутрішньовидових химер-мишей дозволило встановити, що в організмі химери є генотипово різні популяції клітин, тобто генетична мозаїка. Це дозволяє аналізувати механізм дії різних генів, особливо мутантних, у процесі онтогенезу ссавців (Конюхов Б.П., Платонов Е.З., 1985).
Химери-миші отримані ін'єкційним методом, використання якого поглибило знання в проблемі детермінації клітин в онтогенезі. Наприклад, показано, що чим пізніше стадія розвитку ембріона, від якого взята ВКМ для ін'єкції в бластоціль, тим менша ймовірність одержання химер, і, нарешті, на основі ін'єкційного методу було отримано нові дані для розкриття механізму диференціації й малігнізації (від лат. malignus шкідливий, згубний, злоякісне переродження пухлини) клітин. На підставі цих даних з'ясовано, що, наприклад, багато генів які раніше «мовчали» у ракових клітинах, експресуються не тільки в онтогенезі миші, а й у її потомства. Отже, виникнення злоякісних новоутворень може бути обумовлено зміною експресії нормального клітинного генома і не слід розглядати мутації як єдину причину малігнізації.
У зв'язку з цим можна відзначити, що при ін'єкції в бластоцисту ВКМ тератокарциноми, її клітини у разі інтеграції в ембріон втрачають ракові ознаки. Отже, пухлинні клітини під впливом нормальних ембріональних клітин перетворюються на нормальні. Ці дані мають велике значення за виведення химерних тварин, стійких до пухлиннихзахворювань.
В останні роки велика увага приділяється одержанню міжвидових і міжпородних химер ссавців. Це особливо важливо в селекціїсільськогосподарських тварин, тому що міжвидові або міжпородні химери в одному організмі можуть поєднувати різні господарсько-важливі ознаки.
Уперше міжвидові химери були отримані ін'єкційними і агрегаційним методами між двома близькими видами мишей, які звичайно не схрещуються – М.muskulus і М. саrоlі. У міжвидових химер, отриманих шляхом ін'єкції ВКМ М. саrоlі у бластоцисти М. muskulus і пересаджених реципієнтам останнього виду, не виявили імуногенетичної несумісності клітин, і їхній розвиток відбувався нормально. Якщо ж міжвидові химери одержували реципрокною ін'єкцією і розвиток зародків відбувався в організмі М. muskulus, то химери гинули протягом 16 діб після пересадки. Це свідчить про те, що бластоцисти М. саrоlі дегенерують у матці М. muskulus, в той час як агрегація двох генетично різних зародків забезпечує життєздатність химер.
Уперше міжвидові химерні зародки між мишею і пацюком шляхом агрегації морул було отримано у 70-х роках. У 1973 р. в експерименті з ін'єкції ВКМ пацюка в бластоцисту миші химерні бластоцисти були пересаджені в матку миші, де вони розвивалися до 30 пар сомітів (GardnerR. G., JonsjnМ., 1973). У подальших дослідах ці автори отримали всі химерні ембріони до середини вагітності й декілька − до народження. Результати досліджень показали вирішальну роль у виживанні ембріонів сумісності трофобласта і матки.
Створення химер сільськогосподарських тварин. Успіхи, досягнуті в розробці методів створення химерних лабораторних ссавців, дозволили практично підійти до створення химер сільськогосподарських тварин. На початку 80-х років була спроба одержання химерних телят від корів Воstaurus і Воsindicus. У цих експериментах використовували агрегаційний метод, тобто ранні ембріони, що були на стадії морули, обробляли проназою, видаляли іп vitro прозору оболонку і змішаний агрегат бластомерів культивували іп vitro. Пересаджені коровам-реципієнтам химерні морули гинули (Sammer Р.М. еt аl., 1983). Автори довели, що метод агрегації неприйнятний для одержання химерних тварин великої рогатої худоби, тому що важко видалити 5-процентною проназою зону пеллюциду. Крім того, ще немає надійного середовища для культивування іп vitro 8..12-клітинних змішаних агрегатів бластомерів.
Із цих причин дослідники застосували ін'єкційний метод, увівши ВКМ бластоцисти донора в бластоціль реципієнтного ембріона. Ін'єкцію ВКМ робили за описаною раніше методикою R.. Gardnera (1968). Ембріони культивували у фізіологічному розчині Дульбекко з буферним фосфатом і добавками біологічно активнихречовин.
Внаслідок ін'єкції від 1 до 6 клітин 7-денних ембріонів виду Воstaurus у бластоціль виду Воsindicus народилося 7 телят, серед яких одне (8У 29) був ідентифіковано як химерне чотирьох батьків. Фенотипово воно не відрізнялося від однолітків, але за еритроцитарного типирування в нього було виявлено еритроцитарний антиген, типовий для Воstaurus. Автори припускають, що химерізм міг би бути й в інших телят, однак через відсутність відповідних маркерів їм не вдалося точно встановити цей факт.
Останнім часом були отримані міжвидові химери між вівцею і козою, яких назвали вівцекозами. Відомо, що вівця (2n = 54) і коза (2n= 60) не належать до близьких видів і між собою не схрещуються. Уперше таких химерних тварин вивели в 1984 р. у Великобританії (Fehilly С. еt аl., 1984) і у ФРН (Меіnecke-Tillmans, Meinecke В., 1984).
С. Fehilly зі співробітниками, для одержання міжвидових химер між вівцею і козою застосовували агрегаційний та ін'єкційний методи і реципрокні пересадження. Агрегаційним методом було отримано 6, а ін'єкційним методом 2 химери. Шерсть у таких тварин являла собою суміш вихідних видів, роги за будовою були як у кози, але закручені як у барана, проте екстер'єр відповідав одному із батьківських видів. Таким чином, у химер спостерігали мозаїчність тільки волосяного покриву. Цікавим є факт народження ягняти від кози й цапеняти від вівці. Ці так звані однокомпонентні тварини розвивалися з ін'єкційних химер.
У досліді S. Meinecke-Tillman і В. Meinecke, були отримані лише агрегаційні химери. Агрегація зародків відбувалася на стадії 8... 12 бластомерів. Химерні бластоцисти пересаджували в матку вівці. 3 15 трансплантованих ембріонів народилося два ягняти і одне цапеня, але аналіз крові не виявив химерізму. Однак, як і в першому досліді, вівця була здатною виносити цапеня. За припущенням авторів, відсутність імунологічної реакції обумовлено наявністю в плаценті агрегованого зародка клітин овечого генотипу.
У США в Каліфорнійському університеті від ін'єкції ВКМ бластоцисти кіз у бластоцисту овець було отримано овечо-козячіхимери (PolzirV. еtal ., 1987). Двадцять дві химерні бластоцисти хірургічно трансплантували 12 вівцям-реципієнтам. Від 9 суягних овець було отримано 13 нащадків. За електрофоретичним аналізом крові і каріотипом десять тварин віднесли до вівці, одну − до кози і дві − до міжвидових овечо-козячих химер.
У 1987 р. в університеті штату Каліфорнія СІЛА за ін'єкційним методом отримано міжпородні химери вівці − між породами рамбульє і фінський ландрас. З 36 отриманих ягнят у 16 за методом аналізу груп крові і каріотипу було підтверджено химерізм.
У 1982 р. у ФРН ін'єкція хромосомально маркірованих клітин бластоцисти в нормальну бластоцисту великої рогатої худоби і наступне пересадження корові-реципієнтові химерної зиготи призвели до народження химерної телички (8ігап2І§ег О., 1986). Чотири батьки, реципієнт і химерна теличка були досліджені цитогенетичними і біохімічними методами. У цієї телички за рядом ознак установлений химерізм. Автори довели ефективність ін'єкційного методу.
Пізніше у ФРН (1985) було отримано химерних телят після агрегації половинок 32-клітинних ембріонів від корів контрастних порід − швицької (бурої) і голштино-фризської. Із семи народжених телят у п'яти були відсутні ознаки химерізму, а в двох у фенотипі поєднувалася характерна масть вихідних порід − бура і чорно-строката.
У колишньому Радянському Союзі ін'єкційним методом виведено химерний бичок від чорно-рябої і червоної порід, що у фенотипі поєднує чорно-рябу масть із червоними плямами (Л.К.Ернст, 1987).
Таким чином, проведені експерименти показали можливість одержання химер (генетичних мозаїків) у тваринництві.
Химерні тварини не передають нащадкам характерну для них генетичну мозаїчність. Подібно гетерозиготним або гібридним тваринам у нащадків відбувається розщеплення, внаслідок чого порушуються цінні генетичні комбінації. Хоча химерні тварини підтримують господарсько-важливі ознаки лише протягом одного покоління, у розведенні великої рогатої худоби вони можуть викликати великий практичний інтерес. Наприклад, можна створити химерних тварин, що поєднують такі ознаки, як молочна і м'ясна продуктивність, що є антагоністами і несумісні в одному організмі. Створення ін'єкційних химер шляхом введення в ембріон певних ліній клітин дозволить поліпшити імунну систему і підвищити резистентність до ряду хвороб.
Метод одержання експериментальних химер становить великий інтерес для створення ліній (клонів) тварин шляхом партеногенезу. Ембріони ссавців, що розвиваються з партеногенетично активованих яйцеклітин, як показано, гинуть. Однак, за агрегації з біологічно повноцінними ембріонами клітини ранніх партеногенетичних зародків впливають на побудову тканин химерної тварини. Якщо з партеногенетичних клонів клітин будуть формуватися гамети химерної особини, то її генотип можливо закріпити в наступному поколінні.
Важливою особливістю химерних ембріонів є те, що вони підтримують життєздатність клітин зародків летальних генотипів. Наприклад, химери, отримані від нормальних і нежиттєздатних зародків-трисомиків за хромосомами 17, 15 і 12, нормально розвивалися і давали потомство, що не маєтрисомиків. Химерні ембріони становлять великий інтерес для вивчення можливості розробки методів клонування дорослих тварин шляхом партеногенезу. Доведено, що пересадження мишам і великій рогатій худобі химерних ембріонів, які складаються з клітин звичайних (отриманих у результаті запліднення) і диплоїдних гомозиготних гіногенетичних зародків, призвело до народження живого потомства, органи і тканини якого походили як від звичайних, так і партеногенетичних бластомерів. Наступні експерименти підтвердили участь партеногенетичних клітин химерних зародків миші в розвитку ембріона. Отже, для завершення ембріонального розвитку наявність материнських і батьківських хромосом у кожному бластомері не обов'язкова. Для завершення ембріогенезу і народження химерного потомства миші може бути достатньою одна клітина 8-бластомерного звичайногоембріона, агрегованого з 4-бластомерним партеногеноном. Дослідження тканин химерних мишей показало, що всі клітини, що створилися від гаплоїдних партеногенонів, мали диплоідний набір хромосом. Гаплоїдного набору не достатньо для проліферації клітин, тому виживають лише диплоїдизовані клітини. Виходячи з вищевикладеного робимо висновок, що клонування тварин-донорів ооцитів шляхом трансплантації реципієнтам химерних зародків, які складаються з клітин звичайних і амейотичних партеногенетичних ембріонів становить великий інтерес. Такий химерний ембріон може бути отриманий методами мікроманіпуляційшляхом заміни клітин ВКМ звичайної бластоцисти на ВКМ бластоцисти партеногенетичного походження, тобто химерна бластоциста буде складатися з клітин ТЕ звичайної бластоцисти і ВКМ бластоцисти-партеногенона. Наявність батьківських хромосом у трофектодермі химерної бластоцисти, ймовірно, забезпечить імплантацію і формування позазародкових тканин, а можливо, і розвиток ембріона з генотипом партеногенона.
Одержання тварин з бажаними якостями іншим шляхом може стати пересадження химерних ембріонів, що складаються з клітин різновікових партеногенетичних і звичайних зародків. Дослідження показали, що для одержання химерних телят не обов'язково використання одновікових ембріонів. Агрегація ізольованої імунохірургічним способом внутрішньої клітинної маси 8- і 10-денних ембріонів або шляхом розрізу внутрішньої клітинної маси 14-денних ембріонів великої рогатої худоби з 5,5-денними морулами відбувалася в 89, 62 і 0% випадків, відповідно. Трансплантація 8 агрегованих ембріонів, що складаються з клітин 5,5- й 8-денних ембріонів, і 11 ембріонів, що складаються з клітин 5,5- і 10-денних ембріонів, призвела до народження шести і чотирьох телят, відповідно. У першому випадку п'ять з шести телят виявилися химерами, причому з фенотипом, здебільшого характерним для ізольованих клітин внутрішньої клітинної маси.
У даний час обговорюються можливості використання химерних ембріонів за розробки нових підходів до клонування зародків з використанням ембріональних стовбурових клітин (ЕС-клітин). Так, для мишей показана принципова можливість одержання живих нащадків, що повністю утворюються з ЕС-клітин, шляхом введення 12... 15 ЕС-клітин у порожнину бластоцист із вилученої власної ВКМ. Однак, ці мишенята відрізнялися зниженою життєздатністю і загинули незабаром після народження.
Нові можливості в селекції тварин відкриваються з використанням у дослідах за одержання трансгенних тварин бластоцист, у порожнину яких ін'єктовано генетично трансформовані ембріональні стовбурові клітини. Пересадження таких химерних бластоцист може призвести до народження химерних тварин, у яких частина клітин різних органів, у тому числі гонад, буде походити від ембріональних стовбурних клітин. В останньому випадку частина потомства може виявитися трансгенною. Вважається, що такий метод одержання трансгенних тварин є більш ефективним, ніжін'єкціячДНК (чужорідної ДНК) у чоловічий пронуклеус, тому що дозволяє оцінити трансформацію генома ЕС-клітин до їх введення в ембріон.
Більш простий спосіб одержання химерних ембріонів з використанням ЕС-клітин запропонував С. Вуд зі співавторами. Звільнені від прозорої оболонки 8-клітинні ембріони мишей культивували на моношарі ЕС-клітин, після чого ембріони з ЕС-клітинами, що прикріпилися до них, переносили в звичайне середовище і культивували до стадії бластоцисти; у процесі культивування ЕС-клітини колонізували ВКМ бластоцист. Цей спосіб, зазначають автори, є ефективним для одержання химер, скорочує час і спрощує маніпуляції порівняно з введенням ЕС-клітин у порожнину бластоцисти.
Використання химерних ембріонів може розширити можливості дослідників у вирішенні ряду фундаментальних проблем біології розвитку.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 324; Нарушение авторских прав?; Мы поможем в написании вашей работы!