КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна Робота №6
|
|
|
|
Додаток 1
Кров
ЛАБОРАТОРНА РОБОТА № 5
Користуючись джерелами літератури та методичними вказівками надайте визначення поняттям та термінам:
1. Напишіть фізико - хімічні властивості крові - ___________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Осмотичний тиск крові -- ______________________________________
______________________________________________________________________________________________________________________________
Онкотичний тиск крові - ______________________________________
______________________________________________________________________________________________________________________________
Волюмо- і осморецептори – _____________________________________
______________________________________________________________________________________________________________________________
Неорганічні речовини плазми (солі) – ____________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
В'язкість крові – ______________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Питома маса крові – ___________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Буферна ємність крові - _______________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Лужний резерв крові _________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
2. Опишіть механізм дії буферних систем крові
Гемоглобінова буферна система -
Білкова буферна система –
Карбонатна буферна система –
Фосфатна буферна система -
3. Охарактеризуйте формені елементи крові
|
|
|
Еритроцити, їхні функції і властивості - __________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________
Гемоліз еритроцитів та його різновиди - __________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Осмотична резистентність (стійкість) еритроцитів - ___________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Гемоглобін - ___________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Кров'яні пластинки (тромбоцити) - _________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Функції тромбоцитів: ____________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Ретрактозім - ___________________________________________________
______________________________________________________________________________________________________________________________
Тромбоцитарний фактор росту (ТФР) - _____________________________
______________________________________________________________________________________________________________________________
Гемофілія - ____________________________________________________
Фібриноген –___________________________________________________
Дефібринова кров –______________________________________________
Сироватка крові –________________________________________________
_______________________________________________________________
4. Заповніть таблицю Лейкоцити, їх види і значення
| Зернисті лейкоцити (гранулоцити) | Незернисті (агранулоцити) |
4. Опишіть етапи згортання крові –
І. ____________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|
|
ІІ. ____________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
ІІІ. ____________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ретракція - ____________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Фібриноліз - ___________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________
Дослід 1
Взяття крові
Мета роботи: Познайомитися з технікою взяття крові у тварин та людини.
Матеріали та обладнання. Голки для взяття крові, стратифікатори, напівкруглі ножиці; спирт, ефір, пробірки, вата, лимонно-кислий натрій, або гепарін.
Хід роботи: Малу кількість крові (менше 1 мл) у тварин можна брати із підшкіряних крайових вен зовнішньої поверхні вушної раковини. Місце проколу обстригають, дезінфікують спиртом і обробляють ефіром. При вологій шкірі краплина крові розмочується і її важко зібрати в піпетку. З боку основи вуха вену передавлюють, після чого наповнену вену кров’ю проколюють голкою для ін’єкцій, лезом чи спеціальною голкою для взяття крові. Слід уникати повної перерізки вени. Першу краплину крові, яка виступила витирають ватним тампоном і очікують, поки збереться достатня її кількість для аналізу. Попередній масаж та підігрівання забезпечують добру наповненість периферійних судин. По закінченні взяття крові до місця проколу прикладають стерильний ватний тампон.
При необхідності мати для аналізу більше крові, у великої рогатої худоби, коней і овець проколюють яремну вену голкою великого діаметра. Додержуються вимог дезінфекції і, після передавлення яремного жолобу в нижній частині шиї, різким рухом вводять голку в вену. Вістря голки направляють проти току крові під кутом 45°., кров набирають в пробірку. При видалені голки з вени до місця проколу притискують тампон.
|
|
|
У свиней невелику кількість крові одержують, надрізаючи стерильним скальпелем велику вушну вену. Для одержання великої кількості крові відсікають гострими ножицями або скальпелем кінчик хвоста довжиною до 1,5 см. Кров беруть у стерильну пробірку. Рану дезинфікують 5% спиртовим розчином йоду, а кінчик хвоста здавлюють резиновим кільцем або хірургічною петлею з шовку на добу.
У собак невелику кількість крові одержують, надрізаючи край вуха або проколюючи м’яку частин ступні. Велику кількість крові одержують пункцією передньо-зовнішньої плюсневої вени, розміщеної на зовнішній поверхні гомілки. Вену здавлюють нижче колінного суглобу. Голкою проколюють шкіру і стінку вени. Кров набирають у шприц.
У кроликів малу кількість крові беруть з вушної вени зовнішнього краю вуха. Кролика садять у спеціальний ящик з отвором для голови. Перед взяттям крові вухо протирають спиртовим розчином ефіру.
У морських свинок, щурів і мишей для одержання крові надсікають вухо або надрізають кінчик хвоста. При цьому вену вуха чи корінь хвоста здавлюють пальцями. У периферичну частину здавленої вени вводять тонку голку, і кров насмоктують у шприц. Місце проколу до і після взяття крові дезинфікують спиртовим розчином ефіру.
У курей та індиків невеликі порції крові одержують, надрізуючи гребінь або сережки; у гусей і качок проколюють м’якоть ступні. Велику.кількість крові у птиці беруть із підшкірної підкрильцевої вени. При цьому пір’я вищипують, вену здавлюють пальцем в області ліктьового суглобу, прокол роблять під кутом ліктьового вигину. У зв’язку з швидким зсіданням крові у птиці місце проколу вени протирають антикоагулянтом. При цьому краплі крові, що виступили, переносять піпеткою у бюкс з антикоагулянтом. Після взяття крові місце пункції на декілька хвилин зажимають тампоном, змоченим дезинфікуючою рідиною.
У жаби декілька крапель крові можна одержати шляхом ампутації ножицями пальців лапки або шляхом пункції шкірної вени, яка розміщена посередині живота (шкіру спочатку надрізають). Одержують кров також і пункцією оголеного серця.
|
|
|
У людини кров можна взяти, вколовши пучку четвертого пальця на лівій руці. Палець попередньо обробляють спиртом чи ефіром і при можливості зігрівають. Стратифікатором проколюють шкіру на пальці. Першу краплину крові знімають ватним тампоном. По закінченню взяття крові місце проколу дезінфікують і тримають великим пальцем ватний тампон, доки не припиниться кровотеча.
У риб невеликі дози крові одержують із підшкірної або глибокої хвостової артерії. Легким поворотом піпетки навколо осі перерізають стінку артерії, і кров самопливом надходить у піпетку (рис.22). Кров у риб можна брати із серця. Для цього ін’єкційну голку вводять за сагітальною лінією між грудними плавниками з легким нахилом у бік голови. Для видалення слизу на шкірі місце пункції протирають 70% спиртом і просушують тампоном.

Рис. 22. Місця взяття крові в коропових риб
1, 2 – із хвостової артерії; 3 – із зябрової артерії
Висновок:
Дослід 2
Одержання плазми, сироватки, дефібринованої крові та фібрину
Мета роботи. Ознайомитися та оволодіти методикою розподілення крові на її складові компоненти. Отримати кров’яний згусток і визначити об’єм плазми.
Матеріали та обладнання. Мірний циліндр на 10, 20 і більше мл, колби, пробірки, скляні кульки, щавелево- чи лимонокислий натрій або гепарін, марля, скальпель, ножиці, вата, спирт.
Хід роботи:
1. Отримання плазми. Для отримання плазми необхідно запобігти зсіданню крові. В пробірку перед взяттям крові додають антикоагулянт. Кров із яремної вени тварини надходить в пробірку і старанно змішується. Після відстоювання чи центрифугування формені елементи осядуть на дно, а верхній шар являє собою плазму.
2. Одержання кров’яного згустку і сироватки крові. Для отримання сироватки без гемоглобіну необхідно попередити гемоліз. В скляний циліндр чи пробірку обережно, не спінюючи, по стінці посудини набирають кров із вени тварини,. Посудину з кров’ю залишають стояти не менше, як на 15-24 години при температурі 30-38°С Згусток, який утворився, повільно ущільнюється і поступово витискує прозору, жовтуватого кольору сироватку. В згустку залишаються фібрин та формені елементи.
Сироватку можна одержати і іншим способом. Дефібриновану кров розлити в центрифужні пробірки і центрифугувати на протязі 5-6 хвилин. Формені елементи осядуть, зверху залишиться шар сироватки.
3. Одержання дефібринованої крові. Для отримання дефібринованої крові в колбу необхідно покласти скляні кульки і набирати кров. Потім колбу на протязі 10-15 хвилин змішуємо обертальним рухом. Фібриноген у вигляді ниток осяде на кульках; кров, яка залишилася, складається із сироватки і формених елементів. Це і є дефібринована кров. Кров профільтрувати через марлю. Фібрин, який осів на кульках промити в проточній воді. Він має вигляд білої волокнистої речовини.
Дефібриновану кров можна також одержати, збовтуючи свіжу кров в фарфоровій чашці на протязі 8-10 хвилин щіточкою чи мітличкою.
Висновок:
Дослід 3
Визначення швидкості зсідання крові
Мета роботи. Ознайомитися з процесом зсідання крові і факторами, які впливають на швидкість зсідання.
Матеріали та обладнання. Знежирені предметні скельця, скляна лійка, секундомір, стратифікатор, фільтрувальний папір, вата, марля, йод, спирт.
Хід роботи. 1. Взяти шість знежирених сухих предметних скелець. Надрізати судину вуха тварини і нанести на кожне скельце по краплині крові. Точно замітити час взяття крові. Скельця помістити під лійку, стінки якої покрити марлею чи фільтрувальним папером, попередньо змочивши його водою. Через кожні 2 хвилини виймати по одному скельцю і спостерігати за формою краплі. Якщо крапля при нахиленні скельця змінює свою форму - зсідання ще не настало. Якщо зсідання настало, крапля не змінює своєї форми при нахиленні скельця.
Швидкість зсідання крові в хвилинах встановлюється від часу нанесення крові на скло до її зсідання.
2. Краплю крові риби вміщують на предметне скло і накривають лійкою, на стінці якої наклеєний вологий фільтрувальний папір. Через кожні 30 с визначають стан краплі. Час зсідання визначається від моменту одержання крові до моменту втрати краплею текучості.
Дослід повторюють, вмістивши в краплю крові шкірну лусочку або краплю слизу.
Висновок:
Дослід 4
Визначення тривалості кровотечі
Мета роботи. Оволодіти методикою визначення тривалості кровотечі
Матеріали та обладнання. Голки для взяття крові, або стратифікатор, фільтрувальний папір, розкреслений на 16 секторів, годинник, вата, спирт, йод.
Хід роботи. Звичайним способом проколюють палець. Краплину крові, яка виступила, протирають ватою, а потім через кожні 30 сек. Ранку пальця послідовно прикладають до чергового сектору фільтрувального паперу так, щоб в кожному секторі був відбиток лише однієї краплини.
Відмітити, скільки секторів мають сліди крові. Враховуючи, що інтервал між окремими пробами становить 30 сек., визначте тривалість кровотечі і порівняйте її з нормою (біля 4 хвилин).
Висновок:
Дослід 5
Визначення реакції крові
Мета роботи. Навчитися визначати реакцію крові.
Матеріали та обладнання. кров тварини, 10% розчин хлористого натрію, дистильована вода, очні піпетки, смужки універсального лакмусового паперу.
Хід роботи. Смужки універсального лакмусового паперу змочити 10% розчином хлористого натрію. На кожну смужку нанести по краплі крові і через 30с змити дистильованою водою. На аркушику лакмусового паперу залишається пляма, колір якої порівнюють зі стандартною шкалою, що нанесена на етикетці.
Результати досліду:
рН1 =
рН2 =
рН3 =
Висновок:
Дослід 6
Визначення буферних властивостей сироватки крові
Мета роботи. Дослідити буферні властивостісироватки крові. Пояснити механізм дії буферних систем сироватки крові.
Матеріали та обладнання. Дві бюретки по 25 мл, склянки на10-25 мл, піпетки мірні на 1, 2, 10 мл, 0,1 n розчини HCl та NaOH, індикатори фенолфталеїн та метилоранж, сироватка крові.
Хід роботи.
1. Визначення лужного буферу. В одну склянку налити 5 мл дистильованої води і додати 2-3 краплини індикатору метилоранжу. Із бюретки по краплині додають 0,1 n розчин HCl до появи слабко-червоного забарвлення (зазвичай достатньо однієї краплини). В другу склянку налити 5 мл дистильованої води, додати 1 мл сироватки та 2-3 краплини метилоранжу. Титрувати 0,1 n розчином HCl рахуючи кількість крапель до того ж забарвлення, що і в першій склянці.
Провести розрахунок. Для підкислення 5 мл води достатньо однієї краплини кислоти. При додаванні до води 1 мл сироватки потрібно n крапель кислоти. Отже для нейтралізації лужного буферу 5 мл сироватки необхідно використати 5n крапель кислоти.
Формула для розрахунку x=5n.
Результати заносяться до таблиці 11.
Таблиця 11 Результати титрування плазми крові і води
| Вміст пробірки | Об’єм, мл | Кількість краплин HCl |
| Плазма крові | ||
| Дистильована вода |
2. Визначення кислотного буферу. В склянку налити 10 мл дистильованої води і додати 2-3 краплини фенолфталеїну. Із бюретки по краплині додавати 0,1 n розчин NaOH до появи незникаючого слабко-фіолетового забарвлення (звичайно достатньо 2-3 краплини).
В другу склянку відміряти 10 мл дистильованої води, додати 1мл сироватки крові і 2-3 краплини фенолфталеїну. Титрувати 0,1 n розчином NaOH до того ж забарвлення, що і в першій склянці, рахуючи кількість крапель.
Провести розрахунок. Для зміщення реакції 10 мл води в лужний бік необхідна одна краплина лугу. При додаванні до води 1 мл сироватки потрібно n крапель лугу. Отже для нейтралізації кислотного буферу 10 мл сироватки необхідно 10 крапель лугу.
Формула для розрахунку x=10n.
Результати заносяться до таблиці 12.
Таблиця 12. Результати титрування плазми крові і води
| Вміст пробірки | Об’єм, мл | Кількість краплин NaOH |
| Плазма крові | ||
| Дистильована вода |
Висновок:
Дослід 7
Гемоліз еритроцитів
Мета роботи. Прослідкувати за явищем гемолізу еритроцитів під впливом пошкоджуючи чинників з різним механізмом дії.
Матеріали та обладнання. Штатив з пробірками, циліндр на 10 мл, очна піпетка, піпетка мірна на 5 мл, NaCl 0,9 % розчин, глюкоза, 5% розчин, нашатирний спирт, дистильована вода, хлороформ.
Хід роботи: Пронумерувати 6 пробірок. В пробірку №1 внести 5мл фізіологічного розчину, в пробірку № 2 – 5 мл дистильованої води, в пробірку №3 - 5мл розчину глюкози, в пробірку №4 - 4мл фізіологічного розчину і 1мл хлороформу, в пробірку №5 - 4мл фізіологічного розчину і 1мл нашатирного спирту.
В кожну із пробірок внести по 10 крапель дефібринованої крові. Закрити пальцем, тричі перевернути пробірки і поставити в штатив на декілька хвилин. Роздивитися пробірки у проходящому світлі. В усіх пробірках, крім першої (контроль) відбувається гемоліз; розчин набуває прозорості і лакового відтінку. У пробірках № 1-3 гемоліз викликаний осмотичним фактором, у пробірках № 4-5 – хімічним. Хлороформ розчиняє ліпідну мембрану еритроцитів, аміак руйнує її.
Висновок:
Дослід 8
Визначення осмотичної стійкості еритроцитів
Мета роботи. Визначити осмотичну стійкість еритроцитів.
Матеріали та обладнання. Штатив з пробірками, циліндр на 10мл, NaCl 1% розчин, дистильована вода, стабілізована чи дефібринована кров різних видів тварин та птиці.
Хід роботи. Приготувати розчин хлориду натрію різної концентрації, як вказано в таблиці 13. В кожну пробірку внести 5 крапель крові. Закрити пальцем, тричі перевернути пробірки і поставити в штатив на 5-10 хвилин.
Таблиця 13. Схема проведення та результати досліду
| Розчин | № пробірки | ||||||||
| 1% розчин хлориду натрію, мл | |||||||||
| Дистильована вода, мл | |||||||||
| Концентрація хлориду натрію | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| Результат |
Зазвичай у перших трьох пробірках відбувається повний гемоліз (рідина прозора, забарвлена у яскраво – червоний колір, осад еритроцитів відсутній). У четвертій відбувається частковий гемоліз (розчин набуває жовтого або слабо – рожевого забарвлення і не є прозорим), у останніх п’яти пробірках гемоліз не відбувається. Мінімальна резистентність еритроцитів відповідає концентрації NaCl, у якій відбувається частковий гемоліз, максимальна - концентрації NaCl, у якій відбувається повний гемоліз.
Висновок:
Дослід 9
Швидкість осідання еритроцитів
Мета роботи. Ознайомитися з технікою визначення ШОЕ. Дослідити величину ШОЕ у різних видів тварин.
Матеріали та обладнання. Прилад Панченкова, годинникові скельця, лимонно-, щавелевокислоий натрій (5% розчин) або гепарин, кров різних видів тварин.
Хід роботи: Прилад Панченкова складається з градуйованих капілярів, вставлених в штатив; на капілярах є відмітка К (0), а на висоті 50 мм відмітка Р (50). Промити капіляр лимонно - кислим натрієм, або гепарином, наповнити його цим же розчином до відмітки Р. Випустити розчин на годинникове скельце. Одержану кров набрати в той ж самий капіляр до відмітки К, тримаючи піпетку горизонтально. Випустити взяту кров на годинникове скло. Знову набрати кров до відмітки К і знов випустити її на годинникове скло. Кінцем капіляра старанно перемішати обидві порції крові і набрати її в капіляр до відмітки К, уникаючи попадання повітря. Таким чином отримують розведення крові 1:4, тобто 4 об’єму крові і 1 об’єм антикоагулянту. Верхній кінець капіляра зажати вказівним пальцем, нижній обтерти ваткою і поставити в штатив точно вертикально. Засікти час установки капіляра у штатив і через годину відрахувати в міліметрах висоту стовпчика плазми понад еритроцитами, що осіли.
Висновок:
Дослід 10
Визначення кількості гемоглобіну в крові
Мета роботи. Оволодіти методикою визначення гемоглобіну крові.
Матеріали та обладнання. Гемоглобінометр Салі, 0,1 n розчин HCl, піпетки, вата, спирт, настойка йоду, кров, скарифікатор, годинникове скло, дистильована вода.
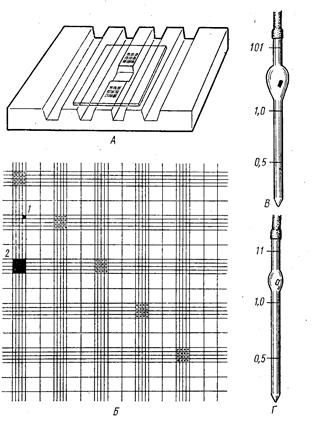
Хід роботи: В градуйовану піпетку гемометра Салі (рис. 21) налити до відмітки з цифрою 2 (10) 0,1 n розчину HCl.

|
.
Рис. 21. Гемометр Салі
1 - штатив гемометра,
2 - запаяні пробітки зі стандартним розчином солянокис-лого гематину,
3 - градуйована пробірка,
4 - піпетка для вимірювання крові
Кров, отриману шляхом проколу крайової вушної вени кролика, насисати в капілярну піпетку до відмітки 02 мм. Опустити капіляр на дно градуйованої пробірки і обережно видути з нього кров так, щоб верхній шар 0,1 n розчину HCl залишався прозорим. Не виймаючи капіляр із розчину, 2-3 рази промити його 0,1 n розчином HCl з верхнього шару. Вийняти капіляр з пробірки, старанно перемішати її вміст скляною паличкою і поставити в штатив на 5 хвилин. Утворений соляно - кислий гематин надає гемолізованій крові коричневий відтінок. Після закінчення вказаного часу до розчину краплинами додають дистильовану воду до отримання рівного однакового забарвлення за стандартом, помішуючи скляною паличкою.
Поділка на шкалі, до якої піднялася рідина, показує кількість гемоглобіну в грам-відсотках і в одиницях Салі. Перерахунок з однієї шкали на іншу дуже простий, наприклад: 15г%  6=90од., 75од:6=12,5г%.
6=90од., 75од:6=12,5г%.
Висновок:
Дослід 11
Одержання кристалів геміну і гемоглобіну
Мета роботи. Ознайомитися і оволодіти методикою отримання кристалів геміну і гемоглобіну.
Матеріали та обладнання. Морська свинка, або кролик, кров коня, мікроскоп, водяна баня, термометр, пробірки, предметні і покривні скельця, скляна паличка, канадський чи піхтовий бальзам, сірчанокислий амоній (насичений розчин), дистильована вода, льодяна оцтова кислота, NaCl кристалічний.
Хід роботи.
1. Отримання кристалів геміну. Краплю крові нанести на предметне скельце, додати до неї одну краплю оцтової кислоти і кристалик NaCl, нагріти до появи пари, після чого препарат обережно підсушити біля полум’я горілки.
Замалювати мілкі кристалики солянокислого геміну, які мають вигляд ромбиків, які часто з’єднуються у вигляді хрестів.
2. Отримання кристалів гемоглобіну:
Перший спосіб. На предметне скельце нанести краплину свіжої крові з вуха морської свинки і краплину піхтового бальзаму. Перемішати скляною паличкою і накрити покривним скельцем. Через 5-10 хвилин помістити препарат під мікроскоп і розглядати його спочатку при малому, а потім при великому збільшенні. Замалювати утворені кристали гемоглобіну вишнево червоного кольору.
Другий спосіб. В пробірку налити 1 мл свіжої крові морської свинки. Поставити пробірку у водяну баню при 60°С і декілька разів струсити пробірку. Через 5-10 хвилин настає гемоліз, кров стає прозорою і в ній починається кристалізація гемоглобіну. Скляною паличкою краплю крові нанести на предметне скельце, накрити її покривним скельцем і розглянути під мікроскопом кристали гемоглобіну.
Третій спосіб. В пробірку налити 1 мл крові коня, додати 2 мл води, вміст змішати з рівною кількістю сірчанокислого амонію і поставити пробірку в штатив на 10-20 хвилин.
Розглянути і замалювати кристали гемоглобіну.
Висновок:
Дослід 12
Підрахунок кількості еритроцитів
Мета роботи. Оволодіти методикою підрахунку еритроцитів у крові в камері Горяєва.
Матеріали та обладнання. Мікроскоп з освітлювачем, камера Горяєва, 2-3% розчин хлориду натрію, голка від шприца, скальпель, ножиці, йод, вата, кролик, кров великої рогатої худоби.
Камера Горяєва (рис 23) складається із товстого предметного скельця з жолобками, розділеного на три плоскі частини. Середня з них розділена поздовжним прорізом на дві площадки. На кожній із них нанесені сітки. Бічні площадки на 0,1 мм вищі середньої і створюють простір (щілину) в 0,1 мм. Сітка камери складається з 225 великих квадратів (15 рядів по 15 великих квадратів в кожному); 25 великих квадратів розділені на 16 маленьких. Загальна площа сітки дорівнює 9мм2. Сторона малого квадрату дорівнює 1/20  1/20=1/400 мм2. Об’єм рідини над малим квадратом 1/40
1/20=1/400 мм2. Об’єм рідини над малим квадратом 1/40  1/10=1/4000 мм2.
1/10=1/4000 мм2.
Хід роботи:
Встановити і розглянути сітку камери при малому збільшенні. Покрити камеру покривним скельцем і притерти. Зробити прокол вушної крайової вени кролика. В капілярну піпетку від гемометра Салі обережно набрати кров до помітки 20 мм3 і перенести в пробірку з 4 мл 2-3% розчину хлориду натрію.
|
Рис. 22. Камера Горяєва
А - камера Горяєва,
Б - сітка камери:
1 - маленький квадрат;
2 - великий квадрат;
В - меланжер для визначення еритроцитів,
Г - меланжер для визначення лейкоцитів.
Верхнім прозорим шаром рідини 2-3 рази промити піпетку і змішати кров з розчином. Одержуємо розведення еритроцитів в 200 разів.
Краплю рідини нанести на поверхню камери біля краю покривного скельця. Крапля повинна підтекти під скло і заповнити камеру. Зачекати 2-3 хвилини, поки станеться зсідання еритроцитів.
Помістити камеру під мікроскоп, знайти сітку і провести підрахунок еритроцитів під малим (8х15) збільшенням.
Еритроцити можуть розподілятися по сітці нерівномірно (рис. 23), через
|
Рис. 23. Розташування еритроцитів
це необхідно підрахувати їх в п’яти великих квадратах або в 80 малих квадратах, вибираючи квадрати по діагоналі сітки.
Для того, щоб не повторити підрахунок одних і тих самих еритроцитів, рахують всі клітини, які лежать усередині квадрата і ті, що розташовані по верхній і правій суміжних лініях.
Підрахунок кількість еритроцитів в 1 мм3 проводиться за формулою
 , або
, або 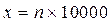 ,
,
де х - кількість еритроцитів в 1мм3 крові, n - кількість еритроцитів в 80 квадратах, 200 - ступінь розведення.
Висновок:
Дослід 13
Кольоровий показник крові
Мета роботи. Вивчення ступеня насиченості еритроцитів гемоглобіном.
Матеріали та обладнання. Дані, отримані у роботах 10 та 11.
Хід роботи. Для визначення кольорового показника необхідно визначити кількість гемоглобіну крові, яка виражена у відносних відсотках (за відношенням до стандарту, який прийнято за 100%), ділять на три перші цифри числа еритроцитів і отримане значення перемножують на 5. Такий спосіб обчислення розрахований на те, що за ідеальних умов (при вмісті гемоглобіну 100% і еритроцитів 5 млн/мм3) кольоровий показник дорівнює (100:500)  5=1.
5=1.
Якщо кольоровий показник менше за одиницю, то таке явище називається гіпохромазією, якщо більше - гіперхромазією.
Для розрахунку величини кольорового показника крові КП необхідно використовувати цифри, які отримані в попередніх роботах: відсотковий вміст гемоглобіну Г в крові і кількість еритроцитів Е в 1мм3 крові; з яких використовують перші три цифри.
Розрахунки проводять за формулою 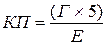 .
.
Висновок:
Морфологічні показники крові різних видів тварин та людини
| Вид тварини | Кількість в 10 мм3 крові | |||
| Еритроцитів, млн. шт. | Лейкоцитів, тис. шт. | |||
| середня кількість | коливання | середня кількість | коливання | |
| Людина Чоловік | 5,0 | 4,5-5,2 | - | 4,0-9,0 |
| Жінка | 4,5 | 4,0-5,0 | - | 4,0-9,0 |
| Кінь | 7,0 | 6,0-9,0 | 9,0 | 7,0-12,0 |
| Корова | 6,5 | 5,0-7,5 | 7,0 | 4,5-12,0 |
| Вівця | 9,5 | 7,0-12,0 | 8,0 | 6,0-15,0 |
| Коза | 15,0 | 12,0-18,0 | 12,0 | 8,0-17,0 |
| Свиня | 6,5 | 6,0-7,5 | 12,0 | 8,0-16,0 |
| Кролик | 6,0 | 4,5-7,5 | 8,0 | 6,5-9,5 |
| Куриця | 3,5 | 3,0-4,0 | 30,0 | 20,0-40,0 |
| Качка | 3,8 | 3,0-4,5 | 30,0 | 20,0-40,0 |
| Гуска | 3,0 | 2,5-3,5 | 25,0 | 20,0-30,0 |
| Жаба | 0,4 | 0,3-0,6 | 9,2 | 2,0-20,0 |
Продовження додатку 1
| Вид тварини | Кількість в 10 мм3 крові | Гемоглобін, г/л | ШОЕ, мм/год. | ||
| Тромбоцитів, тис. шт. | Середня кількість | Коливання | |||
| середня кількість | коливання | ||||
| Людина Чоловік | - | 200-400 | 130-160 | 1,0-10,0 | |
| Жінка | - | 200-400 | 120-140 | 2,0-15,0 | |
| Кінь | 200-500 | 80-140 | 63,2 | ||
| Корова | 260-700 | 90-120 | 0,7 | ||
| Вівця | 260-500 | 70-110 | 0,8 | ||
| Коза | 300-900 | 100-150 | - | ||
| Свиня | 180-300 | 90-110 | 30,0 | ||
| Кролик | 125-250 | 105-125 | 1,5 | ||
| Куриця | 32-100 | 80-120 | 5,0 | ||
| Качка | 35-85 | 100-125 | - | ||
| Гуска | 35-80 | 90-135 | - | ||
| Жаба | 100-300 | 65-85 | - |
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 328; Нарушение авторских прав?; Мы поможем в написании вашей работы!