
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практические константы равновесия
|
|
|
|
Закон действующих масс. Стандартная константа равновесия.
Рассмотрим химическую реакцию, протекающую в изобарно-изотермических условиях. При наступлении равновесия каждое вещество – участник реакции будет характеризоваться относительными парциальными давлениями в момент равновесия ( ). Для подобных систем критерием равновесия служит:
). Для подобных систем критерием равновесия служит: 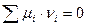
Химический потенциал одного моль идеального газа равен: 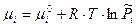
Таким образом, для химической реакции все участники которой газы можно записать условие равновесия:
все участники которой газы можно записать условие равновесия:

 - термодинамическое произведение, которое для нашей реакции записано:
- термодинамическое произведение, которое для нашей реакции записано:
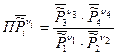
Если в реакции участвует другое количество веществ, то произведение будет включать в себя другое количество множителей. Однако, величины, отвечающие продуктам реакции, всегда будут находиться в числителе, а величины, отвечающие исходным веществам – в знаменателе.
Вернемся к условию химического равновесия:

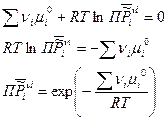
Таким образом, величина 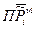 - произведение относительных парциальных давлений в момент равновесия будет зависеть только от температуры и природы реагирующих веществ. Данная величина
- произведение относительных парциальных давлений в момент равновесия будет зависеть только от температуры и природы реагирующих веществ. Данная величина  , называется термодинамической константой равновесия.
, называется термодинамической константой равновесия.
Иногда на практике удобнее пользоваться не термодинамической константой равновесия, а величиной, ей пропорциональной.
- Константа равновесия, выраженная через давление (Кp):

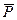 - парциальное давление.
- парциальное давление.
При переходе к относительным парциальным давлениям:


Где 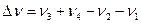
Таким образом, так же как и К0 , КP зависит только от температуры и природы реагирующих веществ. KP=f(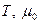 )
)
2. Константа равновесия, выраженная через мольные доли ( ):
):

Мольная доля связана с  законом Дальтона:
законом Дальтона: 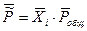
 - относительное общее давление
- относительное общее давление
|
|
|
 ;
; 
Таким образом, 
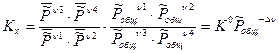
Общее давление в системе может меняться, поэтому  зависит не только от температуры, но и от общего давления в системе. KP=f(
зависит не только от температуры, но и от общего давления в системе. KP=f(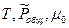 )
)
Не смотря на то, что термодинамическая константа равновесия не зависит от давления, то есть соотношение парциальных давлений в момент равновесия для данной химической реакции при данной температуре есть величина постоянная, количество веществ в момент равновесия может меняться при изменении общего давления в системе 
Представим, что
1)  - реакция идет с увеличением числа молей. В этом случае, рост
- реакция идет с увеличением числа молей. В этом случае, рост  будет уменьшать
будет уменьшать 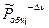 , а следовательно и
, а следовательно и  . Равновесие смещается в сторону исходных веществ.
. Равновесие смещается в сторону исходных веществ.
2)  - реакция идет с уменьшением числа молей. В этом случае, рост
- реакция идет с уменьшением числа молей. В этом случае, рост  будет увеличивать
будет увеличивать 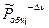 , а следовательно и
, а следовательно и  . Равновесие смещается в сторону продуктов реакции.
. Равновесие смещается в сторону продуктов реакции.
3)  то рост общего давления не как не сказывается на равновесие и на
то рост общего давления не как не сказывается на равновесие и на  .
.
3. Константа равновесия, выраженная через молярную концентрацию Кс


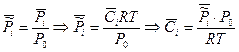
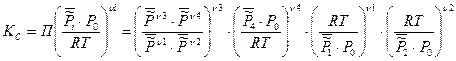

Таким образом, КС будет зависеть от природы реагирующих веществ и от температуры:
KС=f(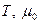 )
)
Термодинамическая константа равновесия есть величина безразмерная, так как относительное и парциальное давление тоже безразмерные величины.
Так же безразмерной величиной будет являться константа равновесия, выраженная через мольные доли.
KP имеет размерность [давление]
KC меет размерность [концентрация]
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1679; Нарушение авторских прав?; Мы поможем в написании вашей работы!