
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства воды
|
|
|
|
На примере данного соединения будет показан общий подход в анализе строения и свойств химических соединений.
Водород и гелий также относятся к S-элементам.
По распространенности во Вселенной водород занимает первое место, а гелий – второе.
Гелий на земле встречается только в атмосфере и содержание его невелико. В химическом отношении это практически инертное вещество, поэтому применяется в автогенной сварке для создания инертной среды. Температура плавления гелия – -271,4 0С (при давлении 3,0 МПа), а температура кипения – -269,9 0С, что позволяет использовать его в качестве хладоносителя в физике низких температур.
Водород довольно распространенный элемент на земле (1%), но в свободном виде (Н2) почти не встречается. Он входит в состав различных соединений.
Водород существует в виде трех изотопов: протий 11Н, дейтерий 21D и тритий 31Т. В природе на 6800 атомов водорода приходится 1 атом дейтерия. Вследствие большой разницы в массах физические и химические свойства изотопов водорода и образуемых ими соединений довольно значительно отличаются. Одним из наиболее распространенных в природе химических соединений водорода является вода.
5. ФИЗИКО–ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
5.1. Строение молекулы воды
В состав молекулы воды входит водород и кислород. Строение молекулы воды определяются соответственно электронным строением атомов кислорода и водорода. Данные элементы имеют следующие электронные формулы:
кислород – 1S22S22P4,
водорода –1S1.
Для образования электронных конфигураций ближайших инертных газов кислороду необходимы 2 электрона, а водороду – 1, т.е. валентности данных элементов равны соответственно 2 и 1, поэтому образующееся из них соединение будет иметь состав – Н2О. Две валентные Р–орбитали атома кислорода расположены под углом 900 и образуют с S–орбиталями двух атомов водородода две S–Р –молекулярные орбитали, обеспечивающие химическую связь. Данные орбитали должны быть расположены также под углом 900, но в действительности валентный угол между двумя S–Р-орбиталями равен 104,50. На рисунке 1 показано строение молекулы воды и в качестве сравнения приведены геометрические модели метана и аммиака.
|
|
|
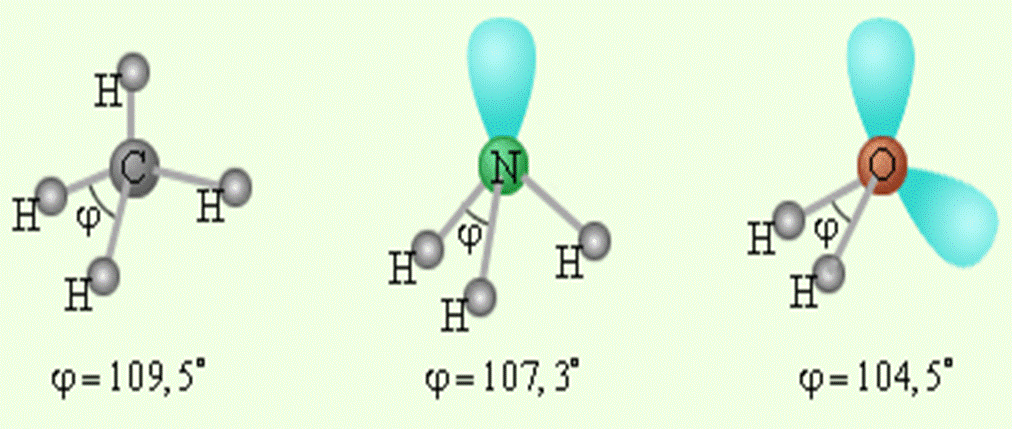
Рисунок 1. Геометрические модели CH4, NH3 и H2O.
Из рисунка 1 видно, что валентный угол 104,50 более близок к тетраэдрическому (109028′) чем к углу 900, т.е.
искажение валентного угла является следствием SР3–гибридизации орбиталей атома кислорода.
Дополнительным подтверждением данного предположения является геометрическая модель молекулы аммиака, у которого только одна свободная орбиталь и валентный угол еще в большей степени приближен к тетраэдрическому.
Бесцветная прозрачная жидкость. Обладает рядом аномальных свойств. Характеризуется высокой теплоемкостью и теплопроводностью. Имеет высокие температуры плавления и кипения. Плотность в кристаллическом состоянии меньше чем в жидком. Данные аномальные свойства являются следствием особенностей строения молекулы воды и образованием водородных связей между отдельными молекулами воды. Основные физико-химические константы воды приведены в таблице 1.
Таблица 1. Основные физико-химические константы воды
| Т пл., 0С | Т кип. 0С | Т крит., 0С | ρ(Н2Ож), г/мл (4 0С) | ρ(лёд), г/мл | С(Н2Ож), Дж/(г · К) | С(лёд) *, Дж/(г·К) | КТ |
| 374,2 | 1,000000 | ~0,9 | 4,18 | 2,12 | 1,86 |
* – при 0 0С
Термодинамические константы воды
| ΔН0298(Н2Ож), кДж/моль | ΔН0298(Н2Ог), кДж/моль | ΔН0298(исп.), кДж/моль | ΔН0298(конд.), кДж/моль | S°298(Н2Ож), Дж/(моль· К) | DG°298 (Н2Ож), кДж/ моль |
| -285,84 | -241,83 | -44,01 | +44,01 | 69,94 | -237,19 |
|
|
|
Плотность жидкой воды максимальна при температуре +4 0С. При охлаждении до температуры +4 0С плотность постепенно возрастает, что обеспечивает перемешивание слоев воды имеющих различную температуру. При температуре 4 0С и ниже конвективный теплообмен прекращается. При достижении верхним слоем жидкой воды температуры 0 0С происходит переход в кристаллическое состояние (лёд), поэтому промерзание водоема начинается с верхнего слоя воды. Так как образовавшийся лед имеет объем примерно на 10% выше объема жидкой воды, он не тонет и располагается на поверхности водоема. Так как теплопроводность льда примерно в два раза ниже теплопроводности жидкой воды, он начинает выполнять функцию теплоизолятора, тем самым тормозя процесс промерзания водоема.
Аномально высокая теплоемкость воды (С(Н2ОЖ)=4,18 Дж/(г·К)), примерно пять раз выше теплоемкости других веществ(например – С(SiО2)=0,79 Дж/(г·К)), является своеобразным регулятором изменения температуры на земле. При переходе от зимы к лету и наоборот изменение температуры происходит относительно плавно.
Лед имеет алмазоподобную кристаллическая модификацию, но вследствие различных длин химических и водородных связей идеальная алмазоподобная структура не образуется, а образуется рыхлая структура с большим количеством пустот. Поэтому плотность льда значительно ниже плотности жидкой воды. Максимальная плотность воды при 4 0С является следствием того, что плавлении льда вначале образуются обломки структуры льда в пустотах которых могут размещаться отдельные молекулы воды, что приводит к увеличению плотности. При дальнейшем повышении температуры тепловое расширение начинает преобладать и плотность воды будет соответственно уменьшаться.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 428; Нарушение авторских прав?; Мы поможем в написании вашей работы!