
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило фаз
|
|
|
|
Існування будь-якої фази в системі або рівновага фаз можливі лише за певних умов, при зміні яких рівновага порушується й речовина переходить з однієї фази в іншу. Можливе перебування певної фази в рівновазі з іншими визначається правилом фаз, або законом рівноваги фаз Гіббса:
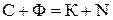 , (3)
, (3)
де С – кількість ступенів вільності (тиск, температура, концентрація), тобто мінімальна кількість параметрів, які можна змінювати незалежно один від одного, не порушуючи рівноваги цієї системи; Ф – кількість фаз системи; К – кількість незалежних компонентів системи; N – кількість зовнішніх факторів, які впливають на положення рівноваги в цій системі.
Для масообмінних процесів N =2, оскільки зовнішніми факторами є температура й тиск. Тоді вираз (3) можна переписати так:
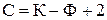 . (4)
. (4)
Тобто правило фаз дозволяє визначити кількість параметрів, які можна змінювати, не порушуючи фазової рівноваги системи.
Наприклад, для однокомпонентної рівноважної системи рідина – пара кількість ступенів вільності становить: 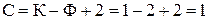 , тобто довільно можна задати лише один параметр – температуру або тиск. Отже, для однокомпонентної системи в умовах рівноваги є однозначна залежність між температурою й тиском (як приклад можна навести залежність між температурою й тиском насиченої водяної пари).
, тобто довільно можна задати лише один параметр – температуру або тиск. Отже, для однокомпонентної системи в умовах рівноваги є однозначна залежність між температурою й тиском (як приклад можна навести залежність між температурою й тиском насиченої водяної пари).
Для однокомпонентної рівноважної системи, що складається з трьох фаз (тверде тіло – рідина - пара), кількість ступенів вільності дорівнює нулю: 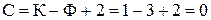 . Так система лід – вода – водяна пара знаходиться в рівновазі при тиску 610,6 Па і температурі 0,01 ˚С.
. Так система лід – вода – водяна пара знаходиться в рівновазі при тиску 610,6 Па і температурі 0,01 ˚С.
Для двокомпонентної рівноважної системи рідина – пара кількість ступенів вільності 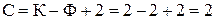 . У цьому випадку однією із змінних величин задаються (наприклад тиском) і отримують однозначну залежність між температурою й концентрацією або (при постійній температурі) між тиском і концентрацією. Залежність між параметрами (температура – концентрація, тиск - концентрація) будують у плоских координатах. Такі діаграми зазвичай називають фазовими.
. У цьому випадку однією із змінних величин задаються (наприклад тиском) і отримують однозначну залежність між температурою й концентрацією або (при постійній температурі) між тиском і концентрацією. Залежність між параметрами (температура – концентрація, тиск - концентрація) будують у плоских координатах. Такі діаграми зазвичай називають фазовими.
Отже, правило фаз визначає можливість співіснування фаз, але не вказує кількісних залежностей перенесення речовини між фазами.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 344; Нарушение авторских прав?; Мы поможем в написании вашей работы!