
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля
|
|
|
|
Изменение термодинамических функций при образовании растворов.
Процесс растворения твердых веществ в жидкостях с образованием истинных растворов можно мысленно разбить на три стадии:
1) ориентация полярных частиц (молекул) растворителя вокруг частиц растворяемого вещества (DН1 > 0);
2) разрушение кристаллической решётки (DН2 > 0);
3) сольватация частиц растворенного вещества в растворе (DН3 < 0).
Суммарный тепловой эффект образования раствора равен:
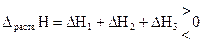 .
.
Образование растворов при смешении двух (и более) жидкостей или растворении газа (газов) в жидкости также сопровождается тепловыми эффектами, связанными с ослаблением связей между частицами растворителя и появлением новых связей между частицами растворителя и растворенных веществ.
Образование любого раствора — процесс самопроизвольный и всегда сопровождается увеличением энтропии: DраствS = DmixS > 0, при проведении его в условиях постоянной температуры и давления энергия Гиббса должна уменьшаться (т.е. DG < 0).
Идеальные растворы образуются лишь в том случае, если вещества, образующие раствор, очень близки по своим свойствам (например, два изотопа или два соседних гомолога). На практике в большинстве случаев при смешении жидких компонентов образуются реальные растворы. В идеальном растворе, состоящем из двух жидких компонентов А и В, все типы взаимодействия (FA-A=FB-B=FA-B) - равноценны. При образовании идеального раствора из отдельных компонентов:
1) тепловой эффект смешения равен 0 (теплота не выдел. и не погл.), т.е. DНсмеш. = 0;
2) объем системы не изменяется, т.е. DVсмеш. = 0;
3) изменение энтропии при образовании идеального раствора совпадает (равно) с изменением энтропии при смешении идеальных газов (для 1 моль смеси DSсмеш. = – R(хAlnxA + xBlnxB).
|
|
|
Здесь хA и xB – молярные доли компонентов A и B, соответственно. При этом идеальные растворы образуются самопроизвольно за счет увеличения энтропии (DSсмеш. > 0), поскольку DНсмеш. = 0. Кроме того, идеальные растворы подчиняются закону Рауля ( рi = p0,i xi) для всех компонентов при всех температурах и концентрациях.
Реальные (неидеальные) растворы не подчиняются закону Рауля. Это бывает, когда силы взаимодействия между однородными молекулами компонентов, из которых образуется раствор, не равны силам взаимодействия между разнородными молекулами компонентов в растворе. (FA-A¹FB-B¹FA-B) При этом многие реальные растворы образуются с выделением или с поглощением теплоты (т.е. DНсмеш. ¹ 0), с изменением объема (т.е. DVсмеш. ¹ 0), а изменение энтропии при их образовании не всегда соответствует соотношению DSсмеш. = - R(xAlnxA + xB lnxB).
Закон Рауля. Рассмотрим двухкомпонентную систему А–В, компоненты которой неограниченно растворимы друг в друге в жидком состоянии и при любых соотношениях образуют идеальный раствор. При нагревании таких растворов в пар переходят оба компонента, поэтому пар состоит из двух веществ. Общее давление насыщенного пара над раствором равно робщ = рА + рВ, где рА и рВ – парциальные давления компонентов А и В соответственно. При этом молярные доли компонентов в паре (yА, уВ), в соответствии с законом Дальтона, будут равны:  ;
; 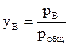 .
.
хА, хВ – молярные доли компонентов А и В в жидкой фазе (растворе);
В 1887 г. Рауль экспериментально установил, что при любой заданной температуре парциальное давление насыщенного пара любого компонента над жидким идеальным раствором прямо пропорционально его молярной доле в растворе.
Это и есть закон Рауля, математически его можно записать в виде:
рА = р0,АхА; рВ = р0,ВхВ, где (11)
р0,А, р0,В – давление насыщ. пара над чистыми жидкими компонентами А и В при данной темп.
|
|
|
В общем виде математическое выражение закона Рауля можно записать следующим образом: pi = p0,ixi.
Изобразим графически данные зависимости (это будут уравнения прямых линий):
 |
Реальные (неидеальные) раcтворы не подчиняются законам идеальных растворов Рауля в форме pi = p0i×xi. Отношение pi / p0i для реальных растворов равно уже не мольной доле, а некоторой функции от температуры и состава раствора: a i = f (T, xi), которую Дж. Льюис назвал термодинамической активностью i -ого компонента в растворе. В связи с этим для реальных растворов будут иметь место два равенства:
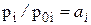 , (12)
, (12)
если пар подчиняется законам идеальных газов и 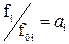 если пар подчиняется законам реальных газов. Активность связана с мольной долей компонента через коэффициент активности
если пар подчиняется законам реальных газов. Активность связана с мольной долей компонента через коэффициент активности  :
:
ai 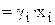
Величина коэффициента активности указывает на степень отклонения реальных растворов от идеальности (законов идеальных растворов).
Если давление насыщенного пара над реальным раствором больше, чем над идеальным раствором того же состава (g i > 1), то отклонения от идеальности называются положительными.
При этом, силы взаимодействия (F) между однородными молекулами компонентов раствора больше сил взаимодействия между разнородными молекулами компонентов раствора (т.е. FА-А > FА-В или FВ-В > FА-В), и переход компонентов в пар будет энергетически более выгодным. Растворы с положительным отклонением от закона Рауля образуются обычно с поглощением теплоты (DH > 0) и увеличением объема (DV > 0).
Если давление насыщенного пара над реальным раствором меньше, чем над идеальным раствором того же состава (g i < 1), то отклонения от идеальности называются отрицательными
При этом силы взаимодействия (F) между однородными молекулами компонентов раствора меньше сил взаимодействия между разнородными молекулами компонентов раствора (т.е. FА-А < FА-В или FВ-В < FА-В), то переход компонентов в пар будет энергетически менее выгодным. Такие растворы обычно образуются с выделением теплоты (DH < 0) и уменьшением объема (DV < 0).
Графически положительные и отрицательные отклонения от закона Рауля для двухкомпонентных систем обычно изображаются следующим образом:
 Положительные отклонения.
Положительные отклонения.
|
|
|
Пунктирная линия – для идеального раствора.
Отрицательные отклонения.
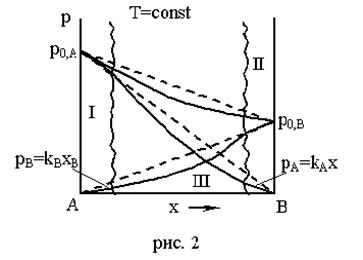
Рассмотрим три области: I, II, III.
Область I – это разбавленный раствор компонента В в А (здесь А – растворитель). В области I давление насыщенного пара растворителя (компонента А) подчиняется закону Рауля (сплошная линия совпадает с пунктирной), а для растворенного вещества В – не подчиняется закону Рауля.
Область II – здесь растворителем является компонент В, а компонент А является растворенным веществом. В этой области давление насыщенного пара компонента В подчиняется закону Рауля, а компонента А – не подчиняется.
Области I и II – это области предельно разбавленных растворов.
Закон Генри.
Предельно разбавленными называются такие растворы, в которых молярная доля растворенного вещества x 2 < 0,005 и, следовательно, молярная доля растворителя x 1 близка к единице.
Поведение растворенного вещества в предельно разбавленном растворе не подчиняется законам идеальных растворов. Давление насыщенного пара растворенного вещества линейно зависит от его концентрации, но прямая линия не совпадает с линией, соответствующей закону Рауля. Давление пара растворенного вещества подчиняется
закону Генри: для предельно разбавленных растворов парциальное давление насыщенного пара растворенного вещества пропорционально его молярной доле:
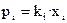 , (13)
, (13)
где xi – молярная доля i -го растворенного вещества; k i – константа с размерностью давления, называемая коэффициентом (константой) Генри.
Заметим, что в области I (рис. 1,2) для компонента В закон Рауля не соблюдается, зато здесь наблюдается прямолинейная зависимость между рВ и хВ, т.е.выполняется закон Генри:
рВ = kВ хВ,, причем kВ ¹ р0,В. Аналогично для области II закон Генри выполняется для компонента А: рА = kА хА.
Таким образом, в предельно разбавленных реальных растворах растворитель подчиняется закону Рауля, а растворенное вещество – закону Генри.
5.3 Диаграммы состояния жидкость-пар для бинарных систем
Обычно для описания состояния растворов используют диаграммы Ткип – x (температура кипения – состав) при р = const или р – x (давление пара – состав) при Т = const.
|
|
|
Рассмотрим случай, когда раствор образован двумя летучими жидкостями.
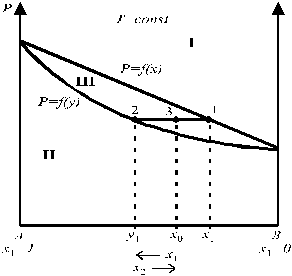 |
Рис. 3. Зависимость общего давления пара от
состава идеального раствора и состава пара.
Точки 1 и 2 на рис. 3 характеризуют состав находящихся в равновесии жидкой и паровой фаз, соответственно. Точка 3 характеризует валовый (общий) состав системы. В области I диаграммы существует только жидкий раствор, в области II — только пар, в области III жидкая и паровая фазы сосуществуют.
Кривая p = f (x) называется линией жидкости и выражает зависимость давления пара над раствором от состава жидкого раствора.
Кривая p = f (y) называется линией пара и выражает зависимость давления пара над раствором от состава пара.
Интересно отметить, что даже в случае образования идеальных растворов состав пара не совпадает с составом жидкого раствора для большинства идеальных растворов. Так, парциальное давление компонента А в паре над раствором по закону Рауля равно:
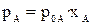 .
.
xA - мольная доля компонента A в растворе.
С другой стороны, из закона Дальтона следует, что
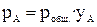 , (14)
, (14)
где р общ. — общее давление пара над раствором, yA — мольная доля компонента А в паре. Тогда
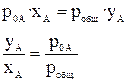
| (15) (16) |
Поскольку давление пара над чистым компонентом A (р 0A) всегда больше общего давления пара для случая, представленного на рис.3, то y A > x A во всей области концентраций. Для таких систем пар обогащен компонентом A по сравнению с жидким раствором.
С точки зрения здравого смысла (и опыта) пар должен быть обогащен более летучим компонентом (т.е. имеющим либо большее давление насыщенного пара при данной температуре Т, либо более низкую температуру кипения при заданном давлении р).
Температурой кипения раствора (Ткип) называют температуру, при которой давление насыщенного пара над раствором равно внешнему давлению p.
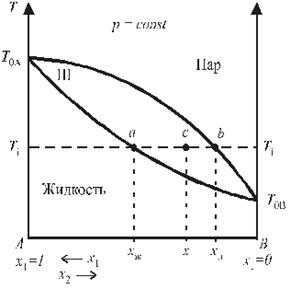
Зависимость температуры кипения от состава раствора и пара представлена на рис. 6. В области I диаграммы существует только пар (раствор газов), в области II — только жидкий раствор; область III является областью сосуществования пара и жидкого раствора.

| 
|
| Рис. 4. Зависимость температуры кипения от состава раствора и пара. | Рис. 5. Диаграмма состояния бинарного раствора при применении к ней правила рычага |
Кривая aa1a2…b называется кривой кипения;
Кривая ab1b2…b — кривой конденсации;
T 0A и T 0B — температуры кипения чистых жидкостей А и В (более летучим компонентом является В, так как T 0A > T 0B).
Правило рычага: отношение количества (массы) двух фаз, находящихся в равновесии в гетерогенной двухфазной области, обратно пропорциональны расстояниям от соответствующих фазовых точек до фигуративной точки системы.
Для точки системы, обозначенной фигуративной точкой (с) Рис. 5, правило рычага можно записать следующим образом:
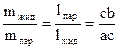 или m жид·l жид = m пар·lпар
или m жид·l жид = m пар·lпар
5.4 Законы Коновалова. Азеотропные смеси.
Соотношения между составами равновесных растворов и их паров, а также общим давлением пара над раствором были установлены Д.П. Коноваловым в 1881 году и носят название законов Коновалова.
Первый закон Коновалова гласит: общее давление пара над раствором растёт с ростом доли в растворе легколетучего компонента.
На этом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимнорастворимых жидкостей.
Второй закон Коновалова касается более частных случаев. Для некоторых реальных растворов с большими отклонениями от закона Рауля на кривых «общее давление пара – состав» могут появляться минимумы или максимумы.
Второй закон Коновалова можно сформулировать следующим образом:
в точках экстремумов на кривых общего давления насыщенного пара (или температур кипения) составы пара и сосуществующего с ним в равновесии жидкого раствора совпадают.
Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 6.
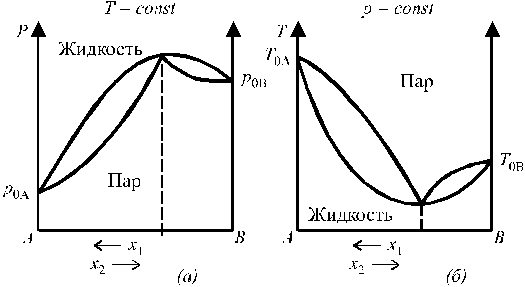 |
Рис. 6. Диаграммы состояния бинарных систем с максимумом
на кривой давления пара (а) и минимумом на кривой температур кипения (б).
Растворы, у которых состав жидкой фазы и пара одинаковы, называются азеотропными, или нераздельнокипящими.
Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами:
-путём химического связывания одного из компонентов;
-путем добавления в систему третьего компонента;
Простая перегонка жидких смесей.
Для разделения смесей жидкостей на практике часто используют метод перегонки, который основан на различии в составах пара и жидкости, из которой пар получен.
Рассмотрим диаграмму кипения двухкомпонентной системы, состоящей из двух неограниченно смешивающихся жидкостей А и В.

T0,A > T0,B
Возьмем жидкость определенного состава, характеризующегося точкой N, и начнем её постепенно нагревать при p = const. Этому процессу соответствует перемещение фигуративной точки по вертикальной прямой NL. В фазовой точке L (от liquid – жидкость), лежащей на кривой жидкости, начинается переход жидкости в пар. Здесь видно, что уВ > хВ (компонента В в паре больше, чем в жидкости), т.е. в соответствии с первым законом Коновалова, пар, по сравнению с жидкостью, обогащен более летучим компонентом В. При дальнейшем повышении температуры фигуративная точка суммарного состава всей смеси будет подниматься вверх по той же вертикали, а фазовые точки пара и жидкости смещаются соответственно по кривым пара и жидкости. При этом количество жидкости уменьшается, а количество пара - возрастает (в соответствии с правилом рычага). При температуре Т1 состав пара характеризуется точкой V1, а состав жидкости - точкой L1, а суммарный состав смеси - фигуративной точкой N1, лежащей на ноде L1N1V1. При температуре Т2 жидкость полностью переходит в пар состав пара соответствует точке V2, т.е. он имеет такой же состав, как и состав исходной жидкости (точка N). При дальнейшем повышении температуры (выше Т2) фазовое состояние системы не изменяется. В результате простой перегонки в остатке можно получить некоторое количество (обычно небольшое) почти чистого труднолетучего компонента А, а хорошо испаряющийся компонент (В) в результате простой перегонки в чистом виде не выделяется.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4242; Нарушение авторских прав?; Мы поможем в написании вашей работы!