
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эбулиоскопия. Криоскопия
|
|
|
|
Эбулиоскопия — метод исследования температур кипения растворов.
Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т 0).
Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества.
Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
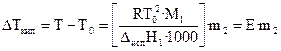 , (28)
, (28)
где М 1 — молекулярная масса растворителя, Dисп Н 1 — энтальпия испарения растворителя, m 2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя).
Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
Криоскопия – метод исследования температур замерзания (кристаллизации) растворов.
Растворы в отличие от чистого растворителя жидкости не отвердевает при одной температуре. При охлаждении растворов наблюдается их замерзание или кристаллизация.
Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы.
Опыт показывает, что температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Т пл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора.
|
|
|
Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
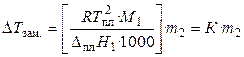 , (29)
, (29)
где М1 — молекулярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
Тогда молекулярная масса растворенного вещества определяется как
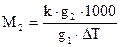 ,
,
 |
где g2- масса растворенного вещества, g1- масса растворителя, К- криоскопическая постоянная.
На рис. 8 представлены температурные зависимости давления насыщенного пара над чистыми жидким и твердым растворителем (кривые ОА и ОD), а также давления насыщенного пара над растворами разных составов (кривые ВО ¢ и СО ¢¢) для случая, когда растворенное вещество нелетучее.
Кривые ОА ¢, O ¢ B ¢, O ¢¢ C показывают ход с температурой давления паров над переохлажденным чистым растворителем (ОА ¢) и переохлажденными растворами соответствующих составов (О ¢ B ¢, O ¢¢ C).
Кристаллы растворителя будут находиться в равновесии с раствором, если давления пара растворителя над твердой и жидкой фазами будут равны, т.е. когда кривая ОD пересечет кривые ВВ ¢, CC ¢ при соответствующих температурах T кр¢ и T кр¢¢. Температуры, отвечающие этому условию, будут ниже температуры замерзания чистого растворителя (T пл –температура плавления растворителя).
Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства растворов называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
|
|
|
К коллигативным свойствам относится и осмотическое давление, которое по Вант-Гоффу равно для разбавленных и концентрированных растворов соответственно:
π=с2RT,
π= a 2RT,
где с2 и а 2 – крнцентрация и активность растворенного вещества.
Осмотическим давлением называют давление, заставляющее переходить растворитель через полунепроницаемую перегородку в раствор, находящийся при том же внешнем давлении, что растворитель.
Коллигативные свойства растворов используются для определения молекулярных масс, а при известных молекулярных массах – для определения степени диссоциации и ассоциации этих веществ в растворах, коэффициентов активности растворенных веществ.
ЛЕКЦИЯ 6
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1271; Нарушение авторских прав?; Мы поможем в написании вашей работы!