
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поверхностные явления. Поверхностное натяжение и методы его определения
Классификация дисперсных систем
Дисперсные системы – это многофазные системы (напр., двухфазные), где одна из фаз является раздробленной (т. е. представлена более или менее крупными частицами) и распределена во второй (непрерывной) фазе.
Коллоидные частицы занимают промежуточное положение между атомами и реальными объектами.
Термин "коллоид" относится к любому веществу независимо от его химического состава, структуры, геометрической формы, агрегатного состояния, если, по крайней мере, один из его размеров менее 1 мкм, но более 1 нм. Это определение дано в традиционном понимании «коллоидно-дисперсных» систем, для которых характерно активное участие частиц в броуновском движении, с вытекающими отсюда молекулярно-кинетическими явлениями (диффузия, осмос). Рассматриваемый современной коллоидной химией диапазон размеров очень широк: от больших, чем простые молекулы, до видимых невооруженным глазом, т. е. от 10-9 до 10-4 м.
Классификация дисперсных систем
в зависимости от размера коллоидных частиц
Таблица 17.1
| Класс систем | Размер частиц d | Дисперсность
 , м -1 , м -1
| Число атомов одной частице | Отдельные предствители | |
| мкм | м | ||||
| Грубодисперсные | Свыше 10 | Свыше 10-5 | Ниже 105 | >1018 | Сахар-песок, пены, грунт, крупа, капли дождя, гранулы лекарственных веществ. |
| Среднедисперсные | 0,1-10 | 10-7-10-5 | 105-107 | >109 | Растворимый кофе, эритроциты крови, сахарная пудра, сажа. |
| Высокодисперсные | 0,001-0,1 | 10-9- 10-7 | 107-109 | 109-103и менее | Сок растений, космическая пыль, рубиновые стекла, золи, наночастицы металлов. |
Размеры частиц в значительной степени определяют свойства дисперсной системы в целом.
Классификация дисперсных систем по агрегатному состоянию дисперсионной среды.
Выделяют восемь различных типов дисперсных систем:
а) системы Т/Ж – лиозоли (гидрозоли, дисперсионная среда - вода); органозоли (дисперсионная среда – органическая жидкость),
б) системы типа Ж1/Ж 2 – эмульсии (вода – нефть, вода – молоко),
в) системы типа Ж/Г и Т/Г – аэрозоли (облака и туманы атмосферы),
г) системы типа Т1/Т2 – минералы, сплавы,
д) системы типа Ж/Т и Г/Т – пористые и капиллярно-пористые твердые тела (влажные грунты, вещества вулканического происхождения, стекла, пемза и др.).
Классификация коллоидных систем по характеру взаимодействия между веществами дисперсной фазы и дисперсионной среды пригодна лишь для систем с жидкой дисперсионной средой. Под взаимодействием фаз дисперсных систем подразумевают процессы сольватации (гидратации), т.е. образование сольватных (гидратных) оболочек из молекул дисперсной среды вокруг частиц дисперсной фазы. Системы, в которых сильно выражено взаимодействие частиц дисперсной фазы с дисперсной средой называются лиофилъные (от греч. лиос – жидкость, фило – люблю). Если частицы дисперсной фазы состоят из вещества, слабо взаимодействующего со средой, системы являются лиофобными (от греч. фобо – ненавижу). В том случае, когда дисперсионной средой является вода, эти два класса можно называть соответственно гидрофильными и гидрофобными системами.
Классификация коллоидных систем по характеру взаимодействия
между веществами дисперсной фазы и дисперсионной среды
Таблица 17.2
| Вид системы | Характер образования | Термодинамическая устойчивость к коагуляции | Представители |
| Лиофобные | Принудительное образование в результате диспергирования и конденсации | Термодинамически агрегативно неустойчивы | Золи, суспензии, эмульсии |
| Лиофильные | Самопроизвольное диспергирование | Термодинамически агрегативно устойчивы | Критические эмульсии, мицеллярные растворы ПАВ, растворы некоторых ВМС, (белков и др.) |
В простейшем случае двухфазной однокомпонентной системы вода – водяной пар энергетическое состояние молекул воды различно.
Молекулы, находящиеся на поверхности раздела, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы и почти не притягиваются к газообразной фазе из-за ее малой плотности. В газовой фазе молекулы воды удалены друг от друга на большие расстояния и силы Ван-дер-Ваальса здесь ничтожны.
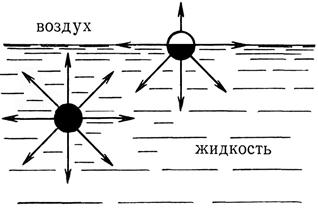
Рис. 17.1 Межмолекулярное взаимодействие внутри жидкости и на поверхности раздела фаз.
Молекулы воды, находящиеся в глубине жидкости, испытывают равномерное воздействие со стороны соседних молекул. Следовательно, молекулы на границе раздела фаз вода-пар принадлежат обеим фазам, но испытывают большое воздействие со стороны жидкости. Поэтому каждая молекула на поверхности раздела фаз обладает большей энергией по сравнению с глубинными молекулами. Свободная избыточная энергия Е в поверхностном слое, отнесённая к 1 см2 поверхности раздела фаз равна:
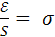 (17.1)
(17.1)
и называется поверхностным натяжением. Поверхностное натяжение можно представить также как силу, действующую на единицу длины.
σ – это важнейшая константа, являющаяся следствием нескомпенсированности молекулярных сил на границе раздела фаз характеризует поверхностное натяжение жидкости (в т.ч. воды). Выражается в эрг/см2, дин/см, Дж/м2 или н/м.
Поверхностное натяжение жидкостей определяется различными методами: например, методом подсчета количества падающих капель по формуле (17.2), по методу наибольшего давления газовых пузырьков (метод
Ребиндера) по формуле (17.3) и др.
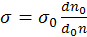 (17.2)
(17.2)
где 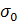 – поверхностное натяжение воды, эрг/см2;
– поверхностное натяжение воды, эрг/см2;
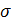 – поверхностное натяжение измеряемой жидкости;
– поверхностное натяжение измеряемой жидкости;
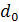 – плотность воды;
– плотность воды;
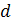 – плотность измеряемой жидкости;
– плотность измеряемой жидкости;
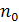 – количество падающих капель воды;
– количество падающих капель воды;
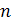 – количество падающих капель измеряемой жидкости.
– количество падающих капель измеряемой жидкости.
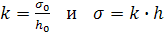 (17.3)
(17.3)
где k – константа капилляра;
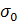 – поверхностное натяжение воды;
– поверхностное натяжение воды;
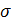 – поверхностное натяжение определяемой жидкости;
– поверхностное натяжение определяемой жидкости;
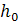 – высота столба жидкости в манометре для Н2О;
– высота столба жидкости в манометре для Н2О;
h – высота водяного столба в манометре для определяемой жидкости.
Поверхностное натяжение, например, воды на границе раздела фаз: вода – водяной пар, вода – воздух, вода – азот, вода – бензол различно.
Поэтому сравнивать поверхностное натяжение различных веществ можно только в том случае, если эти вещества граничат, с одной и той же средой. Обычно его определяют на границе раздела вещество – воздух.
Свободная поверхностная энергия равна произведению поверхностного натяжения а на величину поверхности раздела фаз S и определяется уравнением:
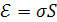
где Ɛ – свободная поверхностная энергия, эрг;
σ – поверхностное натяжение, эрг/см2;
S – поверхность раздела фаз, см2.
Увеличение поверхности раздела фаз всегда повышает свободную поверхностную энергию системы.
Согласно второму закону термодинамики, всякая свободная энергия стремится к минимуму. Этим стремлением объясняется шарообразная форма капли жидкости, самопроизвольное слияние капель жидкости при контакте, поднятие жидкости в капиллярах и др.
Стремление к уменьшению поверхности, обусловленное наличием избытка поверхностной энергии, имеет место и у твердых тел, однако значительные силы, проявляющиеся между частицами вещества в твердом агрегатном состоянии, препятствуют самопроизвольному уменьшению поверхности.
При S = const самопроизвольное уменьшение энергии Ɛ может быть достигнуто за счет уменьшения поверхностного натяжения:
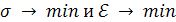 .
.
Этот путь уменьшения Ɛ имеет большое значение для разрешения проблемы адсорбции.
Различают следующие виды сорбционных процессов:
Сорбция – это явление поглощения одним веществом других веществ.
Абсорбция – процесс, при котором поглощенное вещество распространяется по всему объему поглотителя.
Хемосорбция – процесс, при котором поглощенное вещество химически взаимодействует с поглотителем.
Наибольший интерес среди сорбционных процессов представляет адсорбция. Адсорбция – процесс, который происходит на поверхности раздела фаз и сопровождается концентрированием вещества на этой поверхности.
Адсорбция – процесс самопроизвольный, сопровождающийся уменьшением свободной поверхностной энергии за счет уменьшения поверхностного натяжения. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Адсорбция может происходить на любой поверхности раздела фаз: жидкость – газ, твердое тело – газ, твердое тело – раствор, жидкость – жидкость.
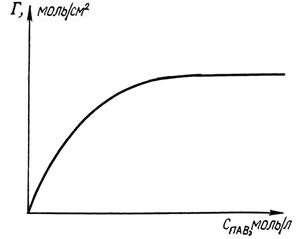
Рис. 17.2 Изотерма адсорбции Гиббса Г– f (СПАВ)
Размерность адсорбции Г – моль/см2, моль/г. Кривые зависимости величины адсорбции от равновесной концентрации или равновесного давления, построенные при t= const, называются изотермами адсорбции.
|
Дата добавления: 2014-01-07; Просмотров: 1125; Нарушение авторских прав?; Мы поможем в написании вашей работы!