
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика. Температура
|
|
|
|
Химическая кинетика. Катализаторы
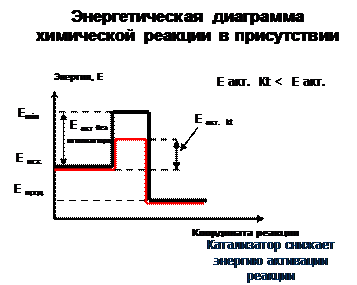
| Катализаторы – вещества увеличивающие скорость реакции, но к концу процесса восстанавливающие свой состав. А + В = C каталитическая реакция: стадия 1: A + Kt =AKt, стадия 2: AKt + B = AB + Kt [Н2О] - катализатор 2Al + 3J2 = 2 Al J3 -∆H Катализатор одинаково ускоряет как прямую, так и обратную реакцию и не смещает равновесие обратимого процесса. |
С увеличением температуры скорость реакции увеличивается.
 Правило Вант-Гоффа:при повышении температуры на каждые 10 градусов скорость химических реакций возрастает в 2- 4 раза.
Правило Вант-Гоффа:при повышении температуры на каждые 10 градусов скорость химических реакций возрастает в 2- 4 раза.
Vt2 и Vt1 - скорости при температурах t2 и t1
g - температурный коэффициент реакции (g =2¸ 4)
Энергия взаимодействующих частиц: Е min. – это та минимальная энергия, которой должны обладать частицы, чтобы каждое их столкновение было эффективным. Е акт. – это превышение минимально необходимой для взаимодействия энергии над средней энергией частиц в системе
• Чем больше энергия активации, тем сложнее протекать реакции
• Е акт. < 40 кДж/моль - реакция протекает мгновенно
• Е акт. > 120 кДж/моль - реакция протекает крайне медленно
 Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции  от температуры
от температуры 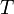 . К – константа скорости, Еакт - энергия активации,
. К – константа скорости, Еакт - энергия активации,
А – предэкспоненциальный множитель (А = р·z),
P – стерический множитель, R – универсальная газовая постоянная
Z – число столкновений в секунду в единице объема


|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 471; Нарушение авторских прав?; Мы поможем в написании вашей работы!