
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов
|
|
|
|
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Пример 1. Вычислите а) процентную (С%); б) молярную (СМ); в) эквивалентную (СН); г) моляльную (См) концентрации раствора H3PO4, полученного при растворении 18г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр Т этого раствора?
Решение. Массовая процентная концентрация показывает число граммов (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300г и, следовательно,
300 – 18 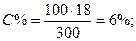
100 – С%
б) мольно–объемная концентрация, или молярность, показывает число молей растворенного вещества, содержащихся в 1 л раствора.. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения
300 – 18 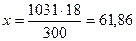
1031 – х
Молярность раствора получим делением числа граммов H3PO4 в 1 л раствора на мольную массу H3PO4 (97,99 г/моль):
СМ = 61,86 / 97,99 = 0,63 М;
в) Эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса H3PO4 = М/З =97,99 / 3 = 32,66 г/моль, то
СН = 61,86 / 32,66 = 1,89 Н
г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу H3PO4 в 1000 г растворителя находим из соотношения
282 – 18 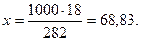
1000 – х
Отсюда См = 63,83 / 97,99 = 0,65 м.
Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т = 61,86 / 1000 = 0,06186 г/см3.
Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр легко найти по формуле:
|
|
|
Т = СН mЭ/1000.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 Н раствора щелочи. Чему равна нормальность кислоты?
Решение: Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1/V2 = CH2/CH1 или V1CH1 = V2CH2.
50CH1 = 25 * 0,5, откуда СН1 = 25 * 0,5/50 = 0,25 Н.
Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН 1092 г. В этом растворе содержится 1092 * 10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 * 0,5 = 522,5 г. В этом растворе содержится 522,5 * 5/100 = 26,125 г КОН.
В общем объеме полученного раствора (2л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора СМ = 135,325/2 * 56,1 = 1,2 М, где 56,1 г/моль – мольная масса КОН.
Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см3,потребуется для приготовления 3 л 0,4 Н. раствора?
Решение. Эквивалентная масса H2SO4 = M/2 = 98,08 / 2 = 49.04 г/моль. Для приготовления 3 л 0,4 Н раствора требуется 49,04 * 0,4 * 3 = 58,848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96/100 = 1,766 г H2SO4.
Следовательно, для приготовления 3 л 0,4Н раствора надо взять 58,848 / 1,766 = 33,32 см3 этой кислоты.
Контрольные вопросы
141. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 Н.
142. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96 Н. 6,3%.
143. К 3 л 10%-ного раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Ответ: 5,0%; 0,82 М.
|
|
|
144. Вычислите эквивалентную и моляльную концентрацию 20,8 %-ного раствора NHO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 Н., 4,17 м, 931,8 г.
145. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38М, 4,14Н, 1,43м.
146. Сколько и какого вещества останется в избытке, если к 75 см3 0,3Н. раствора H2SO4 прибавить 125см3 0,2Н раствора КОН? Ответ: 0,14г КОН.
147. Для осаждения в виде AgCl всего серебра, содержащегося в 100см3 раствора AgNO3 , потребовалось 50см3 0,2 Н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 Н.; 1,433г.
148. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3.
149. Смешали 10 см3 10%-ного раствора NHO3 (пл. 1,056 г/см3) и 100см3 30%-ного раствора HNO3 (пл.1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38%.
150. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3.
151. Какой объем 10%-ного раствора карбоната натрия (пл.1,105г/см3) требуется
для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3) Ответ: 923,1 см3
152. Не нейтрализацию 31 см3 0,16 Н. раствора щелочи требуется.217 см3 раствора Н2S04. Чему равны нормальность и титр раствора Н2S04? Ответ: 0,023; 1,127×10-3 г/см3
153. Какой объем 0,3Н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3.
154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53Н.
155. Какая масса HN03 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г. 0,016 г/см3.
156. Какую массу NaN03 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
157. Смешали 300г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%.
158. Смешали 247г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%.
159. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%.
|
|
|
160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1216; Нарушение авторских прав?; Мы поможем в написании вашей работы!