
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в гетерогенных системах. Расчет растворимости
|
|
|
|
10.1. Константа растворимости малорастворимых электролитов.
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком (твердой фазой) и ионами электролита, например:
ВаSO4 Û Ba2+ + SO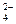
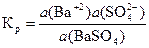
Так как а (BaSO4) = const, то при постоянной температуре произведение Кр× а (BaSO4) есть величина постоянная и называется константой растворимости.
Кs(BaSO4) = a (Ba+2)× a (SO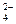 ) или
) или
Кs(BaSO4) = [Ba+2][SO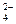 ]
]
так как концентрация ионов в растворе мала и g ~ 1.
Чем меньше величина Ks, тем меньше растворимость данного электролита.
В общем виде Ks(AmBn) = [An+]m[Bm–]n.
Молярная концентрация электролита в растворе обозначается “s“ и называется его растворимостью.
Пример. Напишите выражение произведения растворимости и выведите формулы для расчета растворимости малорастворимых электролитов: а) CuSO4; б) PbBr2; в) Al(OH)3; г) Ca3(PO4)2.
Решение:
а) CaSO4 ® Ca+2 + SO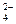
Кs[СaSO4] = [Ca+2]×[SO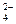 ]
]
Растворимость CaSO4 – s 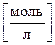 , следовательно,
, следовательно,
[Ca+2] = ×[SO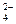 ] = s моль/л, отсюда
] = s моль/л, отсюда
Кs(СaSO4) = s×s = s2 и s = 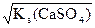
б) PbBr2 ® Pb+2 + 2Br–
Если растворимость PbBr2 – s 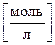 , то [Pb2+] = s моль/л, [Br–] =
, то [Pb2+] = s моль/л, [Br–] =
2s моль/л,
Ks(PbBr2) = [Pb+2][Br–]2 = s(2s)2 = 4s3, а s = 
в) Al(OH)3 ® Al+3 + 3OH–
Если растворимость Al(OH)3 – s 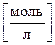 , то [Al+3] = s моль/л,
, то [Al+3] = s моль/л,
[OH–] = 3s моль/л,
Ks(Al(OH)3) = [Al+3][OH–]3 = s(3s)3 = 27s4, а s = 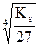
г) Са3(РО4)2 ® 3Са+2 + 2РО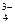
Если растворимость Са3(РO4)2 – s 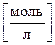 , то [Са+2] = 3s моль/л,
, то [Са+2] = 3s моль/л,
[РО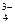 ] = 2s моль/л,
] = 2s моль/л,
Ks(Са3(РO4)2) = [Са+2][ РО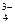 ]2 = (3s)3(2s)2 = 108s5, а s =
]2 = (3s)3(2s)2 = 108s5, а s = 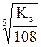
10.2. Условия образования и растворения осадка.
Обозначим произведение концентраций ионов в растворе через Пc.
Если:
а) Пс = Ks, то раствор насыщен, в системе установилось гетерогенное равновесие;
б) Пс > Ks – раствор пересыщен, образуется осадок;
в) Пс < Ks – раствор ненасыщен, осадок растворяется.
Пример: Определить, выпадет ли осадок при смешении равных объемов 0,01М растворов BaCl2 и Na2SO4 (Ks(BaSO4) = 1,1×10–10)
|
|
|
Решение:
Предполагаемое уравнение реакции: BaCl2 + Na2SO4 ® BaSO4 ¯ + 2NaCl
После смешивания равных объемов растворов солей их концентрация уменьшилась вдвое, следовательно, [Ba+2] =  с(BaCl2) = 0,005 моль/л, [
с(BaCl2) = 0,005 моль/л, [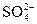 ] =
] =  с(Na2SO4) = 0,005 моль/л.
с(Na2SO4) = 0,005 моль/л.
Пс = [Ba+2]×[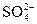 ] = (5×10–3)2 = 2,5×10–5 > Ks, следовательно, раствор пересыщен, осадок образуется.
] = (5×10–3)2 = 2,5×10–5 > Ks, следовательно, раствор пересыщен, осадок образуется.
10.3. Влияние одноименных ионов на растворимость
Если к насыщенному раствору малорастворимого электролита добавить раствор другого электролита, содержащий одноименный ион, то, согласно принципу Ле Шателье, Vкрист. > Vраствор, поэтому растворимость уменьшается.
Пример: Вычислите растворимость AgCl: а) в дистиллированной воде; б) в 0,01М растворе KCl; в) в 0,01М растворе AgNO3. Ks(AgCl) = 1,78×10–10.
Решение:
AgCl ® Ag+ + Cl–
а) s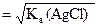 =
= 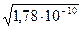 = 1,33×10–5 моль/л;
= 1,33×10–5 моль/л;
б) При добавлении к раствору AgCl раствора KCl равновесие процесса диссоциации AgCl смещается влево, растворимость AgCl уменьшается. Так как Ks(AgCl) = [Ag+]×[Cl–] – величина постоянная при данной температуре, то при увеличении концентрации аниона Cl– концентрация ионов Ag+ уменьшается, т.е. достигается полнота его осаждения.
В 0,01М растворе KCl: [Ag+] = s, [Cl–] = 0,01 + s
Ks(AgCl) = [Ag+][Cl–] = s(0,01+s) = 1,78×10–10.
Можно допустить, что 0,01+ s ~ 0,01, тогда Ks = 0,01s = 1,78×10–10, отсюда s = 1,78×10–8 моль/л. Таким образом, растворимость AgCl в 0,01М растворе KCl уменьшается.
в) При добавлении к раствору AgCl раствора AgNO3 равновесие смещается влево, растворимость AgCl уменьшается, достигается полнота осаждения аниона хлора.
s(AgCl) = 1,78×10–8 моль/л (расчеты аналогичны пункту “б”).
10.4. Влияние одноименных ионов на растворимость.
При приливании к насыщенному раствору малорастворимого электролита индифферентного электролита увеличивается ионная сила раствора, коэффициенты активности и активность ионов уменьшаются, следовательно, раствор становится ненасыщенным, что приводит к дополнительному растворению осадка.
|
|
|
Пример: Определите растворимость СаС2О4 в воде и в 0,01М растворе KNO3.
Ks(CaC2O4) = 2×10–9.
Решение:
СаС2О4 ® Са+2 + 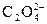
Растворимость СаС2О4 в воде равна s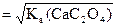 =
=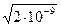 =
=
4,472×10–5 моль/л.
Ионная сила в 0,01М раствора KNO3 равна:
m = 
m = 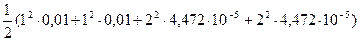 = 0,0102 моль/л
= 0,0102 моль/л
lgg(Ca+2) = lgg(C2O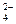 ) = –0,51×22
) = –0,51×22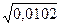 = –0,206
= –0,206
g = 10–0,206 = 0,622
Пс = а (Ca+2)× а (C2O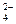 ) = 0,6222×(4,472×10–5)2 = 7,89×10–10.
) = 0,6222×(4,472×10–5)2 = 7,89×10–10.
Таким образом, Пс < Ks, раствор становится ненасыщенным, будет происходить дополнительное растворение осадка.
10.5. Совмещенные гетерогенные равновесия. Конкуренция за анион (катион).
Если к раствору, содержащему смесь ионов, образующих малорастворимые соединения с одним и тем же реагентом, добавить этот реагент, то образование осадков будет происходить ступенчато: в первую очередь образуется наименее растворимое соединение, для которого величина Ks достигается при меньшей концентрации ионов.
Пример: К смеси 0,1М растворов K2SO4, KI и K2S приливаем раствор AgNO3. При этом возможно протекание трех реакций:
Решение:
2Ag+ + 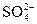 ® Ag2SO4 (Ks = 2×10–5)
® Ag2SO4 (Ks = 2×10–5)
Ag+ + I– ® AgI (Ks = 1,1×10–16)
2Ag+ + S ® Ag2S (Ks = 6×10–50)
а) а (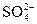 ) = а (I–) = a (S2–) = 0,1 моль/л
) = а (I–) = a (S2–) = 0,1 моль/л
а (Ag+/Ag2SO4) = 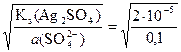 = 1,414×10–2 моль/л
= 1,414×10–2 моль/л
а (Ag+/AgI) = 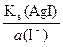 =
= 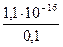 = 1,1×10–15 моль/л
= 1,1×10–15 моль/л
а (Ag+/Ag2S) =  = 7,75×10–25 моль/л
= 7,75×10–25 моль/л
Активность ионов Ag+, необходимая для образования Ag2S, минимальна, следовательно, в первую очередь будет образовываться Ag2S, затем AgI и в последнюю очередь – Ag2SO4, так как активность ионов Ag+, необходимая для его образования, максимальна.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2082; Нарушение авторских прав?; Мы поможем в написании вашей работы!